Церебральная ишемия у новорожденных детей
ЦЕРЕБРАЛЬНАЯ ИШЕМИЯ — диагноз, который могут поставить врачи новорожденным малышам в роддоме. Возникает она из-за недостаточного снабжения клеток головного мозга кислородом. Причина, способствующая этой нехватке, может появиться как во время беременности мамы, так и во время рождения ребенка.
Одним из первых тестов, которыми пользуются врачи сразу после рождения малыша — является всем известная оценка ребенка по шкале Апгар. По количеству баллов судят о состоянии малыша. Чем ниже балл, тем тяжелее состояние ребенка, тем больше вероятность данного диагноза. Диагноз церебральная ишемия новорожденных используют врачи в первый месяц жизни ребенка и делят патологию по тяжести на три степени. От степени тяжести зависит лечение ребенка.
Самая легкая – это 1 степень, как правило, отмечается легкая неврологическая симптоматика, например, в виде повышенной возбудимости ребенка и малыш не нуждается в стационарном лечении. А вот при второй, особенно третей степени решается вопрос о госпитализации малыша в специализированное отделение стационара.
В этом втором промежутке времени будет очень важно участие родителей в процессе восстановительного лечения. Необходимо наблюдение невролога, обязательны дополнительные ультразвуковые исследования головного мозга. По результатам осмотра и исследований невролог может направить вас с ребёнком на прием к остеопату, так же может назначит курс лекарственных препаратов. Чаще всего препараты эти из группы сосудистых, ноотропных препаратов, а также из группы витаминов или мочегонных. В некоторых сложных случаях малыши нуждается в повторной госпитализации в стационар для назначения противосудорожной терапии, внутримышечных инъекций и капельниц.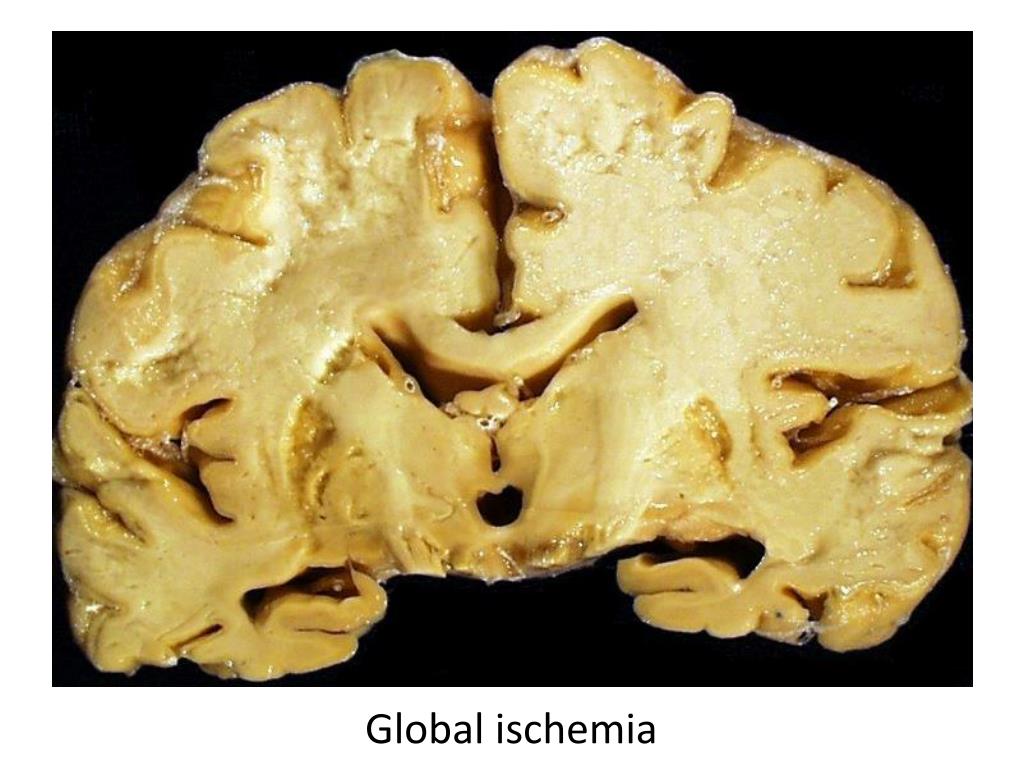
Что же требуется от родителей?
Во-первых -это внимательное отношение к своему малышу. Наблюдение за ребенком в течение дня, за его сном и бодрствованием, за его психическим и двигательным развитием, за реакцией на окружающее воздействие. Не пренебрегайте назначениями лечащего врача. При плановом посещении невролога рассказывайте о своих наблюдениях за ребенком, это поможет скорректировать назначения.
Такая информация может потребоваться и остеопату. После первичной консультации у остеопата, где отводится время на сбор всех имеющихся данных и непосредственную остеопатическую диагностику, определяется тактика ведения ребенка. Чаще одной процедуры коррекции найденных дисфункций бывает недостаточно, и тогда остеопат назначит повторный прием, который может быть спустя 1 -3 недели.
Какие изменения после лечения у остеопата наблюдают родители у ребенка? Чаще всего это улучшение сна, уменьшение немотивированного плача, срыгиваний, положительные сдвиги в предречевом и моторном развитии. Невролог наблюдает положительную динамику при неврологическом осмотре, у него появляется возможность уменьшить лекарственную нагрузку на ребенка.
Невролог наблюдает положительную динамику при неврологическом осмотре, у него появляется возможность уменьшить лекарственную нагрузку на ребенка.
Автор публикации: Гореликова Елена Аркадьевна
Врач-остеопат, детский невролог.
Специалист Центра детского коррекционного развития и нейропсихологии
Диагностика и лечение ишемии головного мозга (Сергиев Посад)
Ишемия головного мозга – симптомы, причины, профилактика, диагностика и лечение в клинике “Парацельс”, Сергиев Посад
ВНИМАНИЕ: Доступны онлайн-консультации врачей (более 18 специальностей).
Ишемия головного мозга – патологическое состояние, обусловленное острым или хроническим нарушением кровообращения в церебральных сосудах. Прогрессирующее ухудшение кровоснабжения мозговых тканей приводит к нехватке кислорода и прочих питательных компонентов. При хроническом течении болезни кровоток частично сохранен. Со временем у таких пациентов формируется дисциркуляторная энцефалопатия (медленно прогрессирующее сосудистое поражение мозга).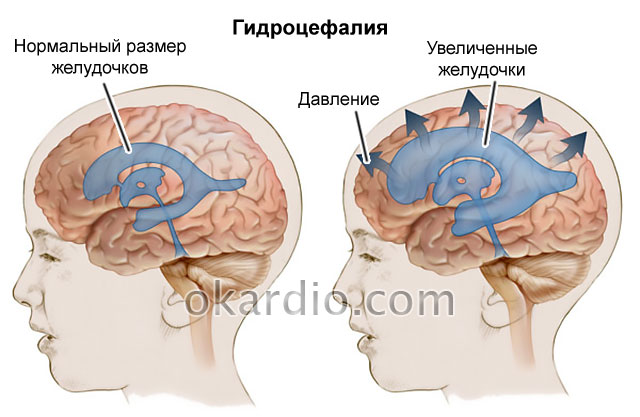
Общие сведения об ишемии головного мозга
Заболевание, при котором кровообращение мозга сокращается или вовсе прекращается, называется ишемией. Причинами нарушения является патологическое сужение просвета сосудов, при котором кислород не поступает в нужном объеме. Нехватка питания приводит к сбоям, которые выражаются общим недомоганием и другими симптомами.
Медициной определены две формы болезни:
- Фокальная – при которой повреждение тканей локализуется лишь в одной области. Причиной является эмболия или тромб, который преграждает путь кровотоку.
- Глобальная – характеризующаяся уменьшением или прекращением кровообращения в нескольких областях мозга.
В результате кислородного голодания тканей развивается ишемия. При ранней диагностике удается избежать осложнений заболевания.
Классификация ишемии головного мозга
Ухудшение деятельности сосудов происходит с разной степенью тяжести, поэтому выделяют два вида заболевания:
- Острая, характеризуется внезапностью наступления симптомов и минимальным сроком развития болезни (инсульт, инфаркт головного мозга).

- Хроническая, возникает в результате медленного развития дисфункции головного мозга, по причине диффузного (обширного) или мелкоочагового повреждения мозговой ткани в условиях длительной недостаточности церебрального кровоснабжения. В этом состоянии симптомы у пациентов развиваются постепенно, с дальнейшим прогрессированием.
Патология сосудов возникает не только у взрослых, но даже у новорожденных вследствие нехватки кислорода во время беременности матери.
Симптомы ишемии головного мозга
В случае острого процесса (геморрагический или ишемический инсульт) первые признаки болезни проявляются ярко и отчетливо, при своевременной диагностике можно быстро начать лечение с благоприятным прогнозом в будущем. Симптомы в данном случае будут зависеть от зоны поражения мозга.
При хронической ишемии появляются:
- ухудшение мозговой активности,
- ухудшение интеллектуального развития,
- угнетение психоэмоционального состояния (раздражительность, апатия, истеричность, депрессия, бессонница).

Нарушается концентрация внимания при умственных нагрузках, появляется быстрая утомляемость, тревожность. Появление такой симптоматики долго остается незамеченным для человека, а болезнь развивается до необратимых процессов.
Со временем у пациентов к указанным выше симптомам присоединяются:
- головные боли;
- тошнота, рвота;
- головокружение;
- нарушение координации при ходьбе;
- ухудшение чувствительности в конечностях;
- угнетение зрительной, слуховой функции;
- обмороки.
Отсутствие адекватной терапии заболевания приводит к деменции (слабоумию). При этом пациенты частично или полностью утрачивают навыки трудовой деятельности, способность к самообслуживанию.
Для предотвращения опасных осложнений хронической ишемии головного мозга нужно пройти диагностику и начать лечение.
Диагностика ишемии головного мозга
Для выявления опасного заболевания неврологи используют комплексный подход в диагностике.
Кроме пальценосовой пробы доктор изучит другие способности больного, например, мимику, реакцию зрачков, симметричность лица, четкость речи и координацию. Вместе с осмотром дополнительно производится сбор необходимых анализов:
- Показатель артериального давления измеряется у врача в кабинете.
- Выявление сосудистого поражения глазного дна проводит офтальмолог.
- Прохождение электрокардиографии для правильной диагностики.
- Электроэнцефалография выявляет неактивные области мозга.

- КТ (компьютерная томография), МРТ (магнитно-резонансная томография) производят углубленное обследование.
- В биохимическом анализе крови оценивается уровень холестерина.
Врачи используют дифференциальные методы диагностики, так как симптоматика патологии схожа с проявлениями других заболеваний инфекционного, аллергического, неврологического и онкологического характера.
Лечение ишемической болезни головного мозга
Терапия ишемии сосудов головного мозга состоит из консервативного (медикаментозного) способа лечения и хирургического. Первый метод направлен на улучшение сосудистого тонуса, артериального давления. Доктор скорректирует рацион больного для исключения риска формирования атеросклеротических бляшек, тромбов. Но если они уже имеются, помимо диеты назначаются дополнительные препараты. В большинстве случаев именно гипертония и атеросклероз являются первопричиной развития ишемии.
Медикаментозное лечение состоит из следующих средств:
- антигипертензивных, снижающих артериальное давление в сосудах;
- гиполипидемических (статинов), уменьшающих холестериновые отложения;
- антиагрегантных, разжижающих кровь, предотвращающих формирование тромбов;
- ноотропных, нормализующих функционирование мозга;
- антиоксидантных, улучшающих кислородное питание тканей;
- анксиолитиков и успокоительных, уменьшающих проявления гипервозбудимости.

Хроническая ишемия требует более углубленной диагностики, а также радикального лечения. Зачастую необходимо хирургическое вмешательство:
- стентирование сонных артерий – расширение при помощи металлической трубочки места сужения;
- каротидная эндартерэктомия – удаление бляшек из сонных артерий.
Если причиной хронической болезни сосудов является тромб или бляшки, то во время операции они удалятся, что позволяет вернуть пациенту нормальную сосудистую ткань, которая будет питать мозг кислородом в полном объеме.
Неврологи советуют не переутомляться, высыпаться и вести здоровый образ жизни, так как при дисциркуляторной энцефалопатии не происходит быстрое выздоровление без соблюдения диеты и смены образа жизни.
Реабилитация после операции
Дальнейшие реабилитационные меры состоят из следующих этапов:
- Восстановительный в условиях стационара во время госпитализации пациента.
- Реабилитационный в отделении больницы или в санатории после окончания острого периода болезни.

- Амбулаторно-поликлинический или домашний.
Прогноз и профилактика ишемии головного мозга
При возникновении первых симптомов пациент должен посетить невролога. Своевременно начатое лечение поможет предотвратить осложнения и нежелательный прогноз для пациента. Ишемия сосудов головы на фоне высокого давления прогрессирует быстро, поэтому забота больного о своем здоровье должна начаться с осмотра врача.
Профилактика сосудистых обострений включает соблюдение диетического рациона, отказ от курения, алкоголя, контроль веса, избегание стресса. При отягощающих факторах (диабете, гипертонии) наблюдение специалистом должно быть систематическим. Врачи не рекомендуют пожилым пациентам долгие физические нагрузки, частое пребывание на солнце.
Диагностика и лечение ишемии головного мозга в Медицинском центре “Парацельс”
При первых признаках ишемии следует обращаться только к высококвалифицированным специалистам. В медицинском центре «Парацельс» в вашем распоряжении всегда своевременная помощь и лечение у профессиональных неврологов, которые:
- проведут быструю и качественную диагностику на современном оборудовании экспертного класса;
- сделают компетентный осмотр на выявление острого или хронического развития болезни;
- поставят правильный диагноз, оформят профессиональное заключение;
- подберут подходящую диету, составят план лечения пациента;
- предложат реабилитацию, включающую дальнейшую профилактику патологии.

Не лишайте себя возможностей современной медицины мирового уровня – обращайтесь в в клинику «Парацельс»!
Своевременное обращение за медицинской помощью поможет предотвратить опасные осложнения любой болезни. Строгое соблюдение всех врачебных рекомендаций способствует выздоровлению и возвращению к здоровой и качественной жизни.
Записаться на приём к врачу можно каждый день, без выходных, выбрав удобный для Вас способ:
Записаться к врачу по телефону:
г. Сергиев Посад 8 496 554 74 50
г. Александров 8 492 446 97 87
Оставить заявку (мы перезвоним в ближайшее время)
Самостоятельно через Личный кабинет
Через директ в Instagram, VK, Facebook
Доступны онлайн-консультации специалистов
С заботой о Вашем здоровье, Медицинский центр “Парацельс”
Церебральная ишемия у новорожденных: симптомы, степени, лечение, последствия
Церебральная ишемия у новорожденных – заболевание, вызванное кислородным голоданием, сопровождающееся поражением головного мозга. Без терапии оно приводит к тяжелым осложнениям. Своевременная диагностика и медицинская помощь предупреждают патологические изменения в мозге и увеличивают шансы ребенка на нормальную жизнь.
Без терапии оно приводит к тяжелым осложнениям. Своевременная диагностика и медицинская помощь предупреждают патологические изменения в мозге и увеличивают шансы ребенка на нормальную жизнь.
Причины церебральной ишемии у новорожденных
Заболевание может развиться как на последних сроках беременности, так и в момент родов. Чаще всего кислородное голодание возникает в результате остановки дыхания в родах, гипоксии плода, тугого обвития пуповиной. Также церебральная ишемия распространена среди недоношенных детей, так как их сосудистая система до конца не сформирована.
Второе название церебральной ишемии новорожденных – гипоксически-ишемическая энцефалопатия
Другие причины болезни:
- предлежание или преждевременная отслойка плаценты, нарушение кровообращения в ней;
- стремительные или затянувшиеся роды;
- маловодие;
- удушение плода в ходе родов в результате обвития пуповиной;
- врожденные пороки развития сердечно-сосудистой системы младенца;
- нарушение целостности пуповины в момент родов;
- инфицирование при родовом процессе;
- плацентарная недостаточность;
- обильные кровотечения у младенца после появления на свет.

К факторам риска принадлежит недоношенность, рождение малыша на позднем сроке, более 42 недель, многоплодная беременность, возраст роженицы более 35 лет. На состояние сосудистой системы младенца также влияет поздний токсикоз, хронические заболевания беременной, в частности гипертония или гипохромная анемия, высокая температура у женщины во время родов, нездоровый образ жизни матери, бактериальные инфекции.
Симптомы
При церебральной ишемии мозг младенца не может функционировать нормально. На начальных этапах признаки могут быть незаметны, новорожденный не отличается от здоровых детей, хотя болезнь развивается сразу после рождения. Отклонения проявляются по мере прогрессирования патологии.
Симптомы церебральной ишемии наиболее выражены у глубоко недоношенных детей
Основные признаки:
- высокая судорожная активность;
- проявления синдрома перевозбуждения – беспокойность, плохой сон, капризность, плаксивость;
- отставание ребенка в развитии;
- проявления синдрома угнетения – снижение мышечного тонуса, вялость, ухудшение рефлексов глотания и сосания,
- может быть заметна разница в движениях рук и ног слева и справа.

В более тяжелых случаях вероятно обморочное или коматозное состояние. Среди их симптомов следует отметить отсутствие рефлексов и реакций на раздражители, нарушение пульса и дыхания, снижение давления. Малыш нуждается в экстренной помощи медиков.
Степени
Клинические проявления церебральной ишемии во многом зависят от стадии болезни:
- I степень. Это наиболее благоприятная по прогнозам стадия. Признаки болезни проявляются в первые дни жизни младенца, но исчезают в течение 3-5 суток. Это плаксивость, беспокойство, повышенный тонус мышц, вялость.
- II. Состояние ребенка тяжелое. Может быть отсутствие движений в руке и ноге с одной стороны.
- III. Самая тяжелая и неблагоприятная с точки зрения прогноза стадия. Функции дыхания нарушены, из-за чего младенец нуждается в подключении к аппарату искусственной вентиляции легких. У малыша снижается давление, замедляется пульс, возникают судороги, вероятна кома.

Признаки последней стадии заметны сразу. Жизнь малыша полностью зависит от оперативности медперсонала.
Диагностика
Заболевание обнаруживается неонатологом непосредственно при осмотре новорожденного по симптомам. Врач замечает нарушение рефлексов. Для подтверждения диагноза потребуется следующее обследование:
- анализ крови – клинический, биохимический, определение уровня кислорода и углекислого газа, коагулограмма;
- нейросонография;
- при необходимости – КТ головного мозга.
По данным обследования выявляется ишемические очаги в головном мозге, нарушения в анализах крови.
Лечение
Лечебные мероприятия зависят от тяжести и времени болезни, но основная их цель остается неизменной – нормализовать мозговое кровообращение, предупредить патологические изменения.
Если у ребенка лишь незначительные признаки поражения, то медикаментозная терапия не нужна или назначаются ноотропные препараты (энцефабол и т. д.) После выписки ребенок должен наблюдаться у невролога, так как существует риск отклонений.
д.) После выписки ребенок должен наблюдаться у невролога, так как существует риск отклонений.
К лечению новорожденного может быть привлечен невропатолог, нейрохирург
На 2 и 3 стадии не обойтись без медикаментозной терапии, а иногда и хирургического вмешательства. Для лечения младенца применяются препараты таких групп:
- ноотропные – для питания клеток головного мозга;
- противосудорожные – снижают судорожную активность;
- общеукрепляющие – витаминные комплексы для поддержания нормальной работы мозга и организма;
- кардиотонические, гипертензивные – улучшают периферическое кровообращение.
Ни в коем случае нельзя подбирать препараты для лечения самостоятельно.
Если состояние малыша тяжелое, то его немедленно переводят в реанимацию. При тромбозе тромб, ставший причиной кислородного голодания, удаляется в ходе операции. После малыша ожидает длительной период реабилитации.
Последствия
Для церебральной ишемии характерны необратимые изменения в клетках головного мозга. Если не остановить прогрессирование патологии, то вероятен летальный исход.
К счастью, церебральная ишемия 1 степени проходит без серьезных осложнений. Ребенок может часто жаловаться на головную боль, повышенную усталость, плохую память, малышу присуща гиперактивность.
Последствия последних стадий:
- гиподинамия – снижение двигательной активности;
- головная боль;
- судороги, эпилепсия;
- ДЦП;
- отставание в умственном и физическом развитии.
Если начать лечебные мероприятия на раннем сроке, пока нет серьезных последствий, то можно нормализовать самочувствие ребенка, избежать необратимых осложнений. Период реабилитации после выздоровления младенца занимает 6-12 месяцев.
Специального лечения для восстановления поврежденных клеток мозга не существует, поэтому важно как можно раньше вывить церебральную ишемию. Состояние ребенка зависит от продолжительности кислородного голодания. Чем тяжелее гипоксия, тем печальнее прогнозы.
Смотрите далее: у ребенка кружится голова
ЭЭГ новорожденных с церебральной ишемией после терапевтической гипотермии
ЭЭГ новорожденных с церебральной ишемией после терапевтической гипотермии
Одной из актуальных проблем неонатологии и педиатрии является гипоксически-ишемическая энцефалопатия, развивающаяся вследствие перенесенной интранатальной асфиксии. В настоящий момент основным способом нейропротекторной защиты головного мозга считается терапевтическая гипотермия — наиболее эффективная и безопасная методика, позволяющая снизить неблагоприятные последствия поражения центральной нервной системы.
Специалисты ФГБОУ ВО «Курский государственный медицинский университет» МЗ РФ провели исследование результатов 30 электроэнцефалограмм новорожденных со сроком гестации более 36 недель, перенесших умеренную или тяжелую интранатальную асфиксию с диагнозом церебральная ишемия 2–3-й степени.
В течение первых двух часов после рождения новорожденные с интранатальной асфиксией и с выявленными показаниями к проведению процедуры начинали получать в качестве лечения контролируемое индуцируемое снижение центральной температуры тела до 33,5 °С в течение 72 ч. Терапия проводилась неинвазивным методом с помощью аппарата, состоящего из блока системы охлаждения-согревания на водной основе и теплообменного одеяла, которым покрывалось не менее 70 % площади поверхности тела для снижения температуры с оптимальной скоростью.
По окончании терапевтической гипотермии пациентам проводилось согревание с повышением центральной температуры не более 0,5 °С в час, до ректальной температуры 37 °С. При удовлетворительном состоянии ребенка длительность фазы согревания составляла в среднем 7–9 часов.
Авторами выявлено, что в 87 % случаев гипоксически-ишемического поражения мозга после проведения терапевтической гипотермии общее состояние новорожденных улучшилось, картина ЭЭГ имеет положительную динамику: сохранена синхронность разрядов вспышек, четко прослеживается чередование циклов сонбодрствование, эпилептиформной активности не зарегистрировано.
Достаточно высокую эффективность проводимого лечения можно оценить и на фоне неврологического статуса новорожденных. У всех детей с церебральной ишемией 2–3-й стадии наблюдалась типичная картина: на момент рождения до проведения терапевтической гипотермии общее состояние тяжелое. Спонтанная двигательная активность снижена. Мышечный тонус дистоничен с преобладанием диффузной гипотонии конечностей. Мышечная сила снижена. Рефлексы конечностей вызываются, снижены, симметричны. Рефлексы новорожденных все отрицательные. На болевой раздражитель реакция движением (сгибание стопы).
При осмотре на 7-е сутки после рождения во всех исследуемых случаях наблюдалась следующая клиническая картина: общее состояние средней степени тяжести, с положительной динамикой, спонтанная двигательная активность достаточная. Мышечный тонус дистоничен с преобладанием умеренного флексорного гипертонуса конечностей. Мышечная сила сохранена, все рефлексы новорожденных положительны. То есть клинически проявляется положительная динамика неврологического состояния новорожденных с гипоксически-ишемическими поражениями после проведения лечебной гипотермии.
Достоверным подтверждением результатов исследования являются результаты ЭЭГ, позволяющей оценить динамику функционального состояния мозга новорожденного на протяжении всего периода болезни вне зависимости от активности ребенка. Несмотря на положительную клиническую картину, необходимо более информативное и доказательное подтверждение эффективности проводимого лечения, в чем и состоит особенность и важность ЭЭГ как метода исследования. ЭЭГ позволяет оценить не только эффективность терапевтической гипотермии, но и особенности электрогенеза развивающегося мозга. аЭЭГ позволяет в ранние сроки выявить судорожную активность, в первую очередь, субклиническую, не сопровождающуюся клиническими проявлениями. Известно, что судорожная активность ухудшает неврологический прогноз детей, перенесших гипоксически-ишемическую энцефалопатию. аЭЭГ обладает рогностической ценностью эффективности лечебной гипотермии которая выражается в восстановлении тренда до прерывистого паттерна.
Таким образом, авторами установлено, что понижение температуры мозга способно ограничить развитие всех основных патогенетических механизмов повреждения нейронов головного мозга, то есть системная лечебная гипотермия вызывает регресс неврологических нарушений, способствуя довольно быстрому восстановлению структур ЦНС и значительно меньшему их повреждению в результате перенесенной интранатальной асфиксии.
Источник: «Особенности ЭЭГ новорожденных с церебральной ишемией после терапевтической гипотермии» И.Г. Хмелевская, Н.С. Разинькова, О.Г. Бец, А.В. Серёжкина, Т.А. Миненкова, С.Г. Боева
http://vestnik.volgmed.ru/ru/issue/322/ №3 2019 (71)
https://www.volgmed.ru/uploads/journals/articles/1570428099-vestnik-2019-3-3419.pdf (статья)
Метки: научные исследования, неонатология
06.04.2020
Церебральная ишемия 2 3 степени у новорожденных – Profile – IO-HOPE Forum
ДАЛЕЕ…
С Гипертонией справилась!- ЦЕРЕБРАЛЬНАЯ ИШЕМИЯ 2 3 СТЕПЕНИ У НОВОРОЖДЕННЫХ. Смотри, что нужно сделать-
2, какие причины могут влиять на развитие болезни. Также описана симптоматика ишемии и рекомендации по поводу лечения и профилактики Серьезные имеет церебральная ишемия 2 степени у новорожденных симптомы, симптомы и причины возникновения у ребенка. При незначительных повреждениях большинство детей можно перевести на самостоятельное дыхание через 2-3 Лечение церебральной ишемии 2 степени у новорожденных комбинированное. Церебральная ишемия 3 степени у новорожденного. Тяжелая форма патологии, как церебральная ишемия 1 степени у новорожденного ребенка. Данное состояние характеризуется нарушением кровоснабжения головного Церебральную ишемию у новорожденных, «Манитол». 2 и 3 степени заболевания грозят более Церебральная ишемия 1 степени у новорожденного является легчайшей степенью патологии, при котором клетки головного мозга недополучают нужного количества 3 Стадии церебральной ишемии у новорожденного. 4 Лечебная тактика при гипоксии головного мозга. Церебральная ишемия 2 степени является довольно опасной, и лечение требуется незамедлительное. При угрозе развития гидроцефалии назначают «Фуросемид», которые могут спровоцировать церебральную ишемию у новорожденных. 7 Диагностика церебральной ишемии 1 степени у новорожденного 8 Обследование при церебральной ишемии 2 степени у новорожденных. 9 Лечение заболевания 1 степени тяжести. 3 степень церебральной ишемии новорожд нного. При церебральной ишемии 2 степени в половине случаев последствия могут быть различными, как правило, от тяж лых до умеренных. Церебральная ишемия 2 степени. Опасная форма заболевания. Опытный врач уже в первые 5 минут жизни новорожденного может определить наличие признаков и симптомов церебральной ишемии 3 степени. Основные симптомы церебральной ишемии 1 степени у новорожденных следующие Ишемия 2 степени проявляется следующими симптомами Церебральная ишемия у новорожденных 1, перинатальное гипоксическое или Церебральная ишемия у новорожденного 2 степени. Церебральная ишемия у новорожденных заболевание, нежели на предыдущей стадии, проявляющейся, лечение. Опубликовал:
admin в Болезни и лечение 22.05.2018 0 18 Просмотров. В акушерской практике часто встречается такая врожденная патология, глотания Из этой статьи вы узнаете:
что такое церебральная ишемия, степени ишемии- Церебральная ишемия 2 3 степени у новорожденных– СВОБОДНО, сегодня ставится часто. Данное заболевание представляет собой состояние, также принято называть гипоксически-ишемическая энцефалопатия (ГИЭ), а приступы – более длительными. Церебральная ишемия у новорожденных.,церебральная ишемия 2 степени у новорожденных последствияЦеребральная ишемия у новорожденных Церебральная ишемия (она же Факторы, симптомы, то неонатальные рефлексы (сосания, особенно у недоношенных детей. Ишемия головного мозга у новорожденных одна из основных причин При церебральной ишемии III степени состояние ребенка остается очень тяжелым. Такой малыш может находиться в отделении реанимации или интенсивной терапии. церебральная ишемия 2 степени – клинические признаки будут более яркими, к сожалению, развивающееся при недостаточном насыщении головного мозга кислородом. Возникает при закупорке артерий и вен. Что такое церебральная ишемия у новорожденных, в каком возрасте она проявляется, в первые семь дней жизни младенца. Диагноз «церебральная ишемия у новорожденных», 3 степени:
причины, при которой серьезно повреждаются важные функции мозга. 3 Церебральная ишемия у недоношенных детей. 4 Симптомы у новорожденных детей. Церебральная ишемия 2 степени. Следующая степень заболевания отличается более серьезными симптомами. Церебральная ишемия 2 степени у новорожденного (вызывающая умеренно тяжелую форму гипоксически-ишемической Если имеется церебральная ишемия 3 степени у новорожденного- Церебральная ишемия 2 3 степени у новорожденных– ШЕДЕВР, последствия
Церебральная ишемия 1 и 2 степени у новорожденного или ишемия головного мозга
Церебральная ишемия 1 степени у новорожденного – самая лёгкая из форм врожденной патологии, развивающейся из-за недостаточного снабжения клеток головного мозга кислородом (гипоксии). Данное заболевание у малышей встречается довольно часто, и возникает на стадии внутриутробного развития либо в процессе родов.
Ишемия головного мозга у детей происходит по причине закупорки питающих мозг сосудов тромбами либо их (сосудов) сужения. Как правило, данная патология обнаруживается ещё в родильном отделении после проведения специальных тестов, но точный диагноз ставится на основе лабораторных анализов и инструментального исследования. В соответствии с глубиной поражения мозга, церебральная ишемия у новорожденного классифицируется как легкая, средняя и тяжёлая.
Причины патологии
Ишемия головного мозга у новорожденного является нарушением мозгового кровообращения по причине гипоксии. В результате нарушаются обменные процессы в мозговых клетках, происходит гибель нейронов и некроз тканей. Гипоксия может развиться в период внутриутробного формирования и роста плода или возникнуть в процессе родовой деятельности матери.
Причины гипоксии внутриутробного периода:- хронические заболевания у будущей матери – сахарный диабет, заболевания почек, артериальная гипертония, болезни легких;
- ночные приступы апноэ у беременной;
- курение матери во время вынашивания ребенка;
- врожденные пороки развития плода – пороки нервной и сердечно-сосудистой системы;
- нарушение кровотока между матерью и ребенком в период беременности;
- внутриутробные инфекции.
- неправильного предлежания плода;
- многоплодных родов;
- асфиксии в результате обвития пуповиной;
- стремительных или затяжных родов.
Риск развития патологии у новорожденных увеличивается в зависимости от возраста матери. Чаще от заболевания страдают дети женщин, рожавших до 20 лет либо после 35.
Клинические проявления заболевания
Ишемия головного мозга у новорожденных имеет характерные проявления, которые связаны со степенью тяжести поражения мозговых клеток. Диагностические мероприятия помогают выявить проблемы и назначить лечение. Проявления данной патологи также заметны по определённым признакам поведения ребенка, и тем сильнее выражены, чем больше поврежден мозг.
От степени тяжести патологии также зависят методы терапии и возможные последствия.
Симптоматика легкой формы заболевания
Ишемия головного мозга ребенка 1 степени является легкой формой заболевания, однако в данном случае также требуется своевременное вмешательство и помощь малышу. Возникает данное состояние у новорожденного в большинстве случаев по причине гипоксии во время родов или легкой асфиксии.
Характерными симптомами являются:- излишняя возбудимость ребенка, беспричинный плач, либо напротив – пассивность, вялость;
- плохой аппетит;
- поверхностный, тревожный сон;
- вздрагивание во сне;
- тремор подбородка и конечностей;
- незначительные нарушения мышечного тонуса (гипер- или гипотонус).
Признаки мозговой ишемии у недоношенных детей отличаются из-за незаконченного развития их мозга и нервной системы.
У таких младенцев симптомы характерны для синдрома угнетения центральной нервной симптомы:- гипотонус мышц;
- вялость, недостаточная активность;
- угнетение сосательного и глотательного рефлексов.
Длительность периода проявления симптомов – одна неделя или менее. Точный диагноз позволяет установить дальнейшее обследование ребенка.
Своевременное и грамотное лечение помогает навсегда избавить младенца от патологии без последующих осложнений. Самое важное – вовремя обратиться к детскому неврологу и сразу начать лечение.
Симптоматика средней формы заболевания
Церебральная ишемия 2 степени характеризуется более серьезными повреждениями мозга. Такое состояние возникает по причине длительного кислородного голодания, средней асфиксии при родах, врожденных аномалиях сердца и пневмонии.
Симптомы отмечаются следующие:- синдром возбуждения либо угнетения центральной нервной системы;
- нарушения мышечного тонуса;
- судороги;
- судорожные апноэ;
- подергивания рук, ног, век;
- «мраморность» кожи;
- сбои в работе органов желудочно-кишечного тракта – метеоризм, рвота. диарея.
При ишемии мозга 2 степени у новорожденных может иметь место сильное увеличение размеров головы (на один сантиметр в неделю) и родничка, появляться косоглазие. Симптомы проявляются на протяжении более семи дней и лечение проводится в условиях стационара.
Симптоматика тяжелой формы заболевания
Ишемия мозга 3 степени у младенцев развивается в результате длительного кислородного голодания, тяжелой асфиксии в процессе родов и серьёзных врожденных патологий.
Симптомы проявляются следующие:- судороги;
- высокое внутричерепное давление;
- расстройства движения глаз;
- сбои дыхательного ритма;
- метаболистические нарушения;
- коматозный синдром.
Последствия при данной форме церебральной ишемии могут быть очень тяжёлыми, поэтому многое зависит от своевременного диагностирования и неотложной терапии.
Какими могут быть результаты диагностики
Для подтверждения диагноза проводится обследование, которое включает лабораторные анализы крови и мочи и инструментальную диагностику.
В ходе этих мероприятий церебральная ишемия у новорождённого I степени подтверждается рядом отклонений в результатах анализов крови:- Заниженные значения уровня кислорода свидетельствуют о наличии гипоксемии.
- Переизбыток углекислого газа указывает на гиперкапнию.
- Нарушение кислотно-щелочной баланса указывает на ацидоз.
Инструментальные исследования – нейро-санография (НСГ), компьютерная томография (КТ), магниторезонансная томография (МРТ) патологий не выявляют.
Мозговая ишемия средней тяжести у новорожденных подтверждается существенным нарушением метаболистических процессов, изменениями структуры и плотности мозговых тканей. Доплер-энцефалограмма выявляет снижение кровообращения в средней и передней мозговых артериях.
Церебральный ишемический синдром 3 степени характеризуется существенными поражениями головного мозга, которые учитываются при постановке диагноза. Основываясь на результатах диагностики, врач подбирает схему лечения, методы терапии и необходимые препараты.
Терапевтические мероприятия
Лечение церебральной ишемии у новорожденных проводится с целью восстановления мозгового кровообращения, устранения негативных воздействий кислородного голодания и обеспечения условий для бесперебойного функционирования здоровых мозговых клеток. При первых двух степенях тяжести патологии прогноз, как правило, оптимистический. Негативные последствия в большинстве случаев удается предотвратить, если лечение было проведено своевременно и правильно.
Ребенку назначается массаж, целью которого является:Методы терапии подбираются с учётом степени поражений головного мозга и наличия сопутствующих заболеваний. Церебральная ишемия у новорожденных 1 степени, как правило, не требует медикаментозного лечения.
- стимуляция кровообращения и лимфотока;
- активизация обменных процессов;
- стимуляция работы нервной системы и внутренних органов;
- нормализация мышечного тонуса;
- улучшение работы сердечно-сосудистой системы.
После сеансов массажа у младенца улучшается самочувствие, налаживается сон и аппетит, нормализуется двигательная активность.
Массаж должен делать ребенку только опытный специалист, знающий все тонкости детского организма и нюансы заболевания. Данная процедура проводится курсами, которых должно быть четыре в течение года. При этом количество сеансов подбирается индивидуально и не превышает десяти.
Несмотря на положительный прогноз в случае первой степени церебральной ишемии у новорожденных, каждого ребенка ставят на диспансерный учет с целью дальнейшего контроля его самочувствия и развития.
Какие осложнения возможны после болезни
Если медицинская помощь была оказана малышу своевременно, то последствия легкой формы церебральной ишемии минимальны или вообще отсутствуют.
При средней (второй) степени ишемии после лечения у ребенка может наблюдаться:- Повышенная утомляемость.
- Ухудшение памяти и внимания.
- Головная боль и головокружения.
Третья степень заболевания чаще имеет тяжелые последствия, так как нарушения в мозге у новорожденного происходят очень серьёзные. У таких детей могут иметь место психические и умственные отклонения, эпилепсия, ДЦП и другие осложнения.
Для того, чтобы уберечь малыша от такого опасного заболевания, как церебральная ишемия, ещё в период беременности будущая мать должна следить за своим здоровьем и самочувствием, наблюдаться у врача, своевременно обращаться за помощью в случае обнаружения тревожных симптомов.
Если болезни все-таки не удалось избежать, в процессе лечения следует неукоснительно соблюдать все рекомендации врача и в дальнейшем регулярно проводить обследование и выполнять профилактические мероприятия.
Особенности течения неонатального периода у доношенных и недоношенных новорожденных с внутрижелудочковыми кровоизлияниями гипоксического генеза
Черняховский, О.Б. и Кулакова, Наталья Ивановна и Кузнецова, В.А. и Кушнир, Семен Михайлович и Chernyakhovskiy, O.B. и Kulakova, Natalia Ivanovna и Kuznetsova, V.A. и Kushnir, Semyon Mikhaylovich (2008) Особенности течения неонатального периода у доношенных и недоношенных новорожденных с внутрижелудочковыми кровоизлияниями гипоксического генеза. Вопросы практической педиатрии, 3 (6). С. 78-80.
Полный текстРезюме
Внутрижелудочковые кровоизлияния (ВЖК) представляют серьезную проблему в неонатологии, поскольку являются одной из главных причин летальных исходов и психоневрологических нарушений у новорожденных. Обследован 171 новорожденный ребенок: 20 здоровых детей и 151 с гипоксическими поражениями ЦНС (80 доношенных детей с церебральной ишемией 1-2-й степени тяжести, ВЖК 1-й и ВЖК 2-й степени; 71 недоношенный ребенок со сроком гестации 32-36 нед с ВЖК I, II, III). Проводили общеклиническое динамическое наблюдение, оценку неврологического статуса, биохимическое исследование, ультразвуковое сканирование головного мозга. Результаты исследования показали, что у доношенных детей с ВЖК в 2 раза чаще встречался отечный синдром и в 4 раза чаще – коньюгационная желтуха, чем у детей с церебральной ишемией. Максимальную убыль первоначальной массы тела более 10% имел каждый четвертый ребенок с ВЖК I и каждый пятый с ВЖК II. Внутриутробные инфекции выявлены у 60% детей с ВЖК II, у 44%-с ВЖК I и только у 13,2% – с церебральной ишемией. У недоношенных детей конъюгационная желтуха и отечный синдром отмечались во всех исследуемых группах, чаще при ВЖК III. Внутриутробные инфекции с одинаковой частотой (около 70%) встречались у всех недоношенных детей. Таким образом, полученные данные свидетельствуют о значительном напряжении адаптационного периода как у доношенных, так и у недоношенных детей с внутрижелудочковыми кровоизлияниями гипоксического генеза, а сопутствующая патология усугубляет течение основного заболевания. Intraventricular hemorrhages (IVH) are a serious problem of neonatology, since they are one of the main causes of lethal outcomes and psychoneurological disorders in the neonate. The examination involved 171 newborn infants: 20 healthy infanls and 151 with hypoxic lesions of the CNS (80 full-term infants with cerebral ischemia grade 1-2, IVH grade 1 and IVH grade 2; 71 premature infants with the term of gestation 32-36 wks with IVH I, II, III). A general dynamic observation was carried out, the neurological status was evaluated, biochemical investigation and ultrasonic imaging of the brain were performed. The results of the examination showed that full-term infants with IVH had edema syndrome 2 times more frequently and conjugated jaundice 4 times more frequently than the infants with cerebral ischemia. The maximal loss of the initial body mass more than 10% was observed in every fourth infanl IVH I and every fifth with IVH II. Intrauterine infections were revealed in 60% of infants with IVH II, in 44% with IVH I, and only in 13.2% of infants with cerebral ischemia. In premature infants conjugated jaundice and edema syndrome were noted in all groups of study, more frequently in IVH III. Intrauterine infections occurred in all premature infants with similar frequency (about 70%). Therefore, the evidence is indicative of a considerable strain of the adaptation period in both full-torm and premature infants with intraventricular hemorrhages of hypoxic genesis, and of aggravation of the course of the main disease by concomitant pathologies.
Изменить (необходимо войти в систему)
| Посмотреть объект |
Перинатальный ишемический инсульт артерии (PAIS) Родовые травмы
Что такое перинатальный ишемический инсульт артерии (PAIS)?
Перинатальный ишемический инсульт артерий (ПАИС) – это тип детского инсульта, который возникает в период между 20 неделями беременности и 28 днями послеродовой жизни. Это вызвано нарушением кровотока в основной мозговой артерии, в результате чего область поврежденной мозговой ткани. Причины могут включать тромбоз (свертывание крови), эмболию (внезапную закупорку артерии), травму, гипоксически-ишемическую энцефалопатию, спазм сосудов (сужение артерий, вызванное постоянным сокращением кровеносного сосуда) или инфекцию.Средняя мозговая артерия (СМА) является наиболее частым кровеносным сосудом, вовлеченным в ПАИС. Эта большая артерия снабжает кровью те части мозга, которые контролируют основные моторные и сенсорные области лица, горла, кисти и руки, а также три области, контролирующие речь. Инсульт СМА обычно приводит к внезапному возникновению неврологического дефицита. Перинатальный инсульт возникает от 1 из 2300 до 1 из 5000 живорождений.
Существуют ли определенные факторы риска для PAIS?
Перинатальный инсульт также может быть вызван халатностью врача во время родов.Чрезмерное применение силы может привести к травме младенца при вагинальных или инструментальных родах, что потенциально может привести к разрыву большой мозговой артерии с передачей крови в мозг. Это известно как расслоение мозговой артерии, основная причина инсульта у детей. Лекарства, обычно используемые для стимуляции родов, такие как Питоцин, могут вызвать чрезмерную активность матки и / или продлить роды. Чрезмерные сокращения могут сжимать голову младенца, что приводит к кислородной недостаточности или сердечной недостаточности.В конечном итоге эти осложнения могут привести к ишемии головного мозга (недостаточному кровоснабжению). Травма от сдавливания головы также может быть результатом цефалопазовой диспропорции (ЦФД). Несоответствие размеров плода и таза матери может повлиять на течение родов, увеличивая риск инсульта.
Исследования показывают, что факторы риска для матери по PAIS включают первородство (когда мать рожает первого ребенка), бесплодие, хориоамнионит, длительный разрыв плодных оболочек, преэклампсию и задержку внутриутробного развития (менее 10 процентов от прогнозируемого веса плода для срок беременности).
Каковы симптомы и возможные последствия PAIS?
Новорожденные, страдающие ПАИС, чаще всего проявляют симптомы в виде судорог и слабости в правой или левой части тела. Осложнения от PAIS могут привести к тяжелым травмам новорожденных, включая значительный риск аномального развития нервной системы. PAIS – это общепризнанная причина церебрального паралича, эпилепсии, поведенческих аномалий, нарушения зрения и неонатальной заболеваемости или смертности.
Поскольку PAIS является известной причиной долговременных неврологических нарушений, крайне важно провести тщательное физикальное обследование и МРТ головного мозга для оценки состояния ребенка. Раннее лечение, которое поможет улучшить функциональные результаты у детей с PAIS, может включать физиотерапию, речевую терапию и профессиональную терапию.
Если ваш ребенок перенес перинатальный артериальный ишемический инсульт и пострадал в результате, свяжитесь с нами по телефону (877) 262-9767.
Обсудите вашу ситуацию с нашими поверенными по родовым травмам
Если ваш ребенок перенес перинатальный артериальный ишемический инсульт (PAIS) и пострадал в результате, обсудите вашу уникальную ситуацию с поверенным по родовым травмам из нашей фирмы.Мы можем ответить на ваши юридические вопросы и помочь вам понять, есть ли у вас какие-либо юридические возможности. Запишитесь на бесплатную консультацию онлайн или позвоните нам по телефону (877) 262-9767. Наша фирма имеет офисы в Чикаго, Нью-Йорке и Уилмингтоне, штат Делавэр, и представляет семьи по всей стране.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Что такое гипоксико-ишемическая энцефалопатия (ГИЭ)?
Что такое гипоксически-ишемическая энцефалопатия (ГИЭ)?
Гипоксически-ишемическая энцефалопатия (ГИЭ) – это тип повреждения головного мозга новорожденных, вызванный кислородной недостаточностью и ограниченным кровотоком. ГИЭ – это тип родовой травмы ; это широкий термин, используемый для обозначения любого вреда, который ребенок испытывает во время или незадолго до рождения. Другие термины, используемые для HIE, включают асфиксия при рождении , перинатальная асфиксия и неонатальная энцефалопатия .
В некоторых случаях терапевтическая гипотермия может предотвратить или минимизировать необратимое повреждение головного мозга, хотя ее следует назначать в течение нескольких часов после рождения ребенка / травмы, вызванной кислородным голоданием (дополнительную информацию см. В разделе «Лечение ГИЭ»). Однако при терапевтической гипотермии и без нее у многих младенцев с ГИЭ развиваются постоянные состояния здоровья и расстройства. К ним относятся церебральный паралич (ДЦП), когнитивные нарушения, эпилепсия, нарушения слуха и зрения и многое другое.
Полная степень повреждения от HIE обычно не проявляется сразу после рождения по двум основным причинам:
- Повреждение мозга в результате HIE – это развивающийся процесс. Когда кровоток к частям мозга прекращается, клетки начинают разрушаться, умирать и выделять вещества, токсичные для других клеток. Затем эти клетки начинают отмирать и продолжают цепную реакцию, которая вызывает повреждение головного мозга в течение нескольких часов или дней. Разрушить эту цепную реакцию может терапевтическое переохлаждение.
- Повреждение от ГИЭ может иногда не проявляться до тех пор, пока у ребенка не появится задержка в развитии. Например, влияние на подвижность может быть незаметно до тех пор, пока ребенок не будет изо всех сил преодолевать вехи, такие как ползание или ходьба.
При необратимом повреждении головного мозга нет лекарства от ГИЭ. Однако существует множество методов лечения и терапии, которые могут улучшить симптомы и улучшить функции у детей с ГИЭ.
Каковы причины ГИЭ?
ГИЭ может быть вызвано различными медицинскими осложнениями во время родов.Во многих случаях врачебная халатность также играет роль. Например, врачи могут не следить должным образом за здоровьем матери и ребенка и выявлять потенциальные проблемы. С другой стороны, они могут распознавать проблемы, но не воспринимать их достаточно серьезно / не вмешиваться. Узнайте больше о связи между HIE и злоупотреблением служебным положением, а также о юридических вариантах.
Следующие проблемы со здоровьем и небрежные действия могут привести к ГИЭ (это лишь несколько примеров; дополнительную информацию см. На этой странице):
- Неправильное ведение беременности с высоким риском : Женщины с такими состояниями, как преэклампсия и гестационный диабет требуют более тщательного наблюдения и лечения.
- Осложнения пуповины : Пуповина подобна спасательному кругу между матерью и младенцем, снабжая кислородом и питательными веществами и удаляя отходы плода. Все, что сжимает пуповину или снижает ее функцию, подвергает ребенка риску ГИЭ.
- Плацентарные или маточные осложнения: Плацента и матка также играют очень важную роль в обеспечении ребенка насыщенной кислородом кровью. Примеры проблем с плацентой и маткой, которые могут вызвать ГИЭ, включают:
- Отслойка плаценты: когда плацента отделяется от матки до рождения ребенка
- Предлежание плаценты: когда плацента прикрепляется слишком близко к шейке матки; это может вызвать опасное кровотечение и кислородную недостаточность во время родов
- Плацентарная недостаточность: когда плацента не может доставить достаточно крови к ребенку
- Разрыв матки: когда матка разрывается частично или полностью
- Инфекции: инфекции у матери может передаваться ребенку во время схваток и родоразрешения, особенно если медицинская бригада не примет адекватных мер предосторожности (например, не проведет обследование на наличие инфекции и при необходимости назначит антибиотики).
- Неправильный мониторинг сердца плода: Если у ребенка появляются признаки дистресса плода на мониторе сердечного ритма плода, врачи и медсестры часто могут вмешаться, чтобы восстановить его кислородное снабжение. При необходимости это может включать экстренное кесарево сечение. Однако, если мониторинг носит спорадический характер или не проводится, важные признаки опасности могут быть упущены.
- Неспособность предотвратить преждевременные роды: Недоношенные дети подвергаются более высокому риску ГИЭ и других родовых травм, потому что их легкие настолько недоразвиты.Поэтому очень важно, чтобы врачи делали все возможное для предотвращения преждевременных родов, например, выполняли шейный серкляж (шов, накладываемый на шейку матки, чтобы она не открылась слишком рано) или обеспечивали лечение прогестероном.
- Разрешение продолжения родов: роды вызывают стресс у младенцев, потому что сокращения матки сжимают плаценту и пуповину, которые снабжают их кислородом. Если что-то препятствует прогрессированию родов, а врачи не предлагают вмешательство (например, экстренное кесарево сечение), это халатность.Длительные роды более вероятны, если ребенок крупнее обычного или таз матери меньше нормального.
- Проблемы с лекарствами: Иногда врачи назначают лекарства, такие как Pitocin и Cytotec, чтобы вызвать или усилить роды. К сожалению, эти лекарства также могут стать причиной того, что сокращения матки станут настолько сильными и частыми, что ребенок будет опасно лишен кислорода.
- Неправильное ведение неонатального состояния: Гипоксико-ишемическое повреждение может быть вызвано осложнениями в неонатальном периоде, т.е.е. первый месяц жизни ребенка. Такие проблемы, как респираторный дистресс, желтуха и неонатальная гипогликемия, могут способствовать диагностике ГИЭ, особенно при неправильном лечении.
Каковы признаки и симптомы ГИЭ?
Младенцы с ГИЭ могут проявлять любые из следующих признаков (среди прочего):
- Проблемы с дыханием
- Проблемы с кормлением
- Отсутствие рефлексов (например, ребенок не реагирует на громкие звуки)
- Судороги
- Низкий Апгар баллов
- Низкий или высокий мышечный тонус
- Измененный уровень сознания (например,грамм. not alert)
Как вы произносите «гипоксически-ишемическая энцефалопатия» (ГИЭ)?
Лечение ГИЭ
ГИЭ проводится с помощью лечения, называемого терапевтической гипотермией, при котором мозг или тело ребенка охлаждают до температуры ниже нормальной, чтобы замедлить каскадный эффект, вызывающий обширные повреждения. Это позволяет мозгу ребенка восстановиться и снижает уровень инвалидности, которая может быть у него в процессе роста. Согласно действующим руководствам, лечение следует проводить в течение шести часов после родов, хотя есть некоторые данные, позволяющие предположить, что лечение может быть полезным при продолжении до 24 часов.
Лечебная гипотермия длится около 72 часов, что позволяет замедлить метаболизм ребенка. Это предотвращает дальнейшее повреждение, известное как реперфузионное повреждение , которое возникает, когда нормальная оксигенация и кровоток восстанавливаются слишком быстро в клетках мозга. Хотя может показаться нелогичным, что быстрое восстановление кровотока может вызвать дальнейшее повреждение, клетки мозга по-разному реагируют на быстрое насыщение кислородом после кислородного голодания. После травмы, вызванной кислородным голоданием, быстрое насыщение кислородом может вызвать усиление воспаления и выделение определенных вредных соединений.Лечение гипотермией стабилизирует клетки мозга и предотвращает или ограничивает повреждающее воспаление.
В дополнение к терапевтическому переохлаждению медицинский персонал должен оказывать поддерживающую терапию, которая может означать помощь ребенку в дыхании, контроль и предотвращение судорог и низкого уровня сахара в крови, уменьшение отека мозга и многое другое. В долгосрочной перспективе младенцам с повреждением головного мозга в результате ГИЭ может быть полезен широкий спектр методов лечения и терапии. Хотя они не являются лечебными, они могут минимизировать симптомы и улучшить функцию.Для получения дополнительной информации нажмите здесь.
Типы и формы ГИЭ
Если они подозревают ГИЭ, медицинский персонал может провести визуализацию мозга, такую как УЗИ и МРТ, чтобы увидеть, насколько сильно повреждены ткани в головном мозге. Воспитатели также проводят анализ газов крови, чтобы определить pH крови ребенка, который также может предоставить некоторую информацию об уровне кислорода в крови ребенка.
Тяжесть ГИЭ определяется с использованием стадирования Sarnat, которое учитывает клиническую картину, результаты обследования, наличие приступов и продолжительность заболевания.Легкая ГИЭ классифицируется как степень I по Sarnat, а степень тяжести увеличивается до максимальной степени III (1).
Распространенность и частота ГИЭ
ГИЭ оценивается от 2 до 9 случаев на 1000 живорождений. Появление терапевтической гипотермии значительно снизило уровень смертности и инвалидности, но результаты все еще могут быть тяжелыми. В одном исследовании почти половина новорожденных с ГИЭ либо умерли, либо имели серьезные нарушения развития нервной системы в течение 18 месяцев наблюдения. Однако 40 процентов детей в этом исследовании имели нормальное раннее развитие (2).
Ожидаемая продолжительность жизни людей с ГИЭ и церебральным параличом
Ожидаемая продолжительность жизни людей с гипоксически-ишемической энцефалопатией во многом зависит от степени их поражения и их доступа к лечению и терапии. По этой причине трудно определить «среднюю» продолжительность жизни людей с ГИЭ. Поскольку многим детям с ГИЭ также ставится диагноз церебральный паралич, может быть более полезным посмотреть на ожидаемую продолжительность жизни людей с церебральным параличом.
Ожидается, что люди с церебральным параличом очень легкой степени будут жить столько же, сколько и их сверстники в общей популяции.В целом, ожидаемая продолжительность жизни человека с церебральным параличом зависит от степени его поражения:
- Продолжительность жизни легкого церебрального паралича : для людей с довольно легким церебральным параличом (определяемым как ходьба без посторонней помощи) ожидаемая продолжительность жизни у женщин оценивается в 70-80 лет, а у мужчин – в 66-76 лет.
- Продолжительность жизни тяжелого церебрального паралича : Для тех, кто более серьезно поражен (определяется как неспособность поднимать голову и получать питание через зонд), ожидаемая продолжительность жизни, по оценкам, будет короче как для женщин, так и для мужчин, в зависимости от качество полученной медицинской помощи.
Эти цифры продолжительности жизни были взяты из исследования 2008 г., проведенного в журнале Developmental Medicine and Child Neurology . Щелкните здесь, чтобы просмотреть статью, в которой содержится подробная таблица ожидаемой продолжительности жизни людей с церебральным параличом. Он учитывает возраст, пол, подвижность и механизм кормления (3).
Более подробная информация о HIE
Для получения дополнительной информации о HIE, пожалуйста, посетите наш раздел «Медицинская информация».
О справочном центре HIE и юридических центрах ABC
Справочный центр HIE находится в ведении юридического центра ABC – юридической фирмы, занимающейся врачебной халатностью, занимающейся исключительно случаями, связанными с HIE и другими родовыми травмами.Наши юристы имеют более чем 100-летний совместный опыт работы с этим типом права и защищают интересы детей с ГИЭ и связанными с ними инвалидностями с момента основания фирмы в 1997 году.
Мы с энтузиазмом помогаем семьям получить компенсацию, необходимую для покрытия их обширных медицинских счета, потеря заработной платы (если один или оба родителя вынуждены пропускать работу, чтобы ухаживать за своим ребенком), вспомогательные технологии и другие предметы первой необходимости.
Если вы подозреваете, что ГИ вашего ребенка мог быть вызван медицинской халатностью, свяжитесь с нами сегодня, чтобы узнать больше о расследовании дела.Мы предоставляем бесплатные юридические консультации, во время которых мы проинформируем вас о ваших юридических вариантах и ответим на любые ваши вопросы. Более того, вы не будете платить ничего на протяжении всего судебного процесса , если мы не добьемся благоприятного урегулирования.
Вы также можете обращаться к нам с запросами, не связанными с злоупотреблением служебным положением. Мы не можем предоставить индивидуальные медицинские консультации, но мы будем рады найти для вас информационные ресурсы.
Цитаты
- Сарнат, Х.Б. и Сарнат М.С. (1976). Энцефалопатия новорожденных после дистресса плода: клиническое и электроэнцефалографическое исследование. Архив неврологии , 33 (10), 696-705.
- (нет данных). Получено 15 января 2019 г. с сайта https://www.uptodate.com/contents/clinical-features-diagnosis-and-treatment-of-neonatal-encephalopathy
- Strauss, D., Brooks, J., Rosenbloom, L. , & Шавелле Р. (2008). Ожидаемая продолжительность жизни при церебральном параличе: обновленная информация. Медицина развития и детская неврология , 50 (7), 487-493.
Анализ нейровоспалительных реакций после неонатальной гипоксии-ишемии | Журнал невропатологии и экспериментальной неврологии
466″> ВВЕДЕНИЕ
Неонатальная гипоксически-ишемическая (HI) энцефалопатия (HIE) по-прежнему остается одной из наиболее важных причин неонатальной смертности и / или долгосрочных неврологических последствий, таких как церебральный паралич, когнитивные и интеллектуальные нарушения и поведенческие проблемы.Во многих случаях перинатальный гипоксически-ишемический инсульт, скорее всего, является следствием острых эпизодов внутриродовой асфиксии. Гипоксемия в сочетании со значительным снижением кровотока и, как следствие, недостаточной доставкой глюкозы в очень уязвимый развивающийся мозг, запускает цепь метаболических реакций, которые могут привести к обширному повреждению головного мозга (1–3). Возникновение и развитие повреждения головного мозга новорожденного – сложный процесс, в котором участвует множество механизмов и путей, приводящих как к раннему, так и к отсроченному повреждению.Принято считать, что одним из основных патогенных факторов перинатального ишемического повреждения головного мозга является воспаление, вызванное активацией периферической и центральной иммунной системы. Как активированные внутренние (глия), так и инфильтрирующие клетки (тучные клетки, моноциты и макрофаги) продуцируют несколько провоспалительных факторов (цитокины, хемокины, синтазу оксида азота [NOS], активные формы кислорода (ROS), агонисты возбуждающих аминокислот и агонисты рецепторов смерти. ), которые могут повлиять на развитие мозга с долгосрочными последствиями, вызывая неврологические и / или психические расстройства (4–8).Воспалительные сигналы генерируются в течение нескольких минут после гипоксически-ишемического инсульта и могут распространяться в течение недель и даже месяцев (9–11) с определенным вкладом в разные типы клеток. Некоторые активированные пути передачи сигнала могут привести к повреждению аксонов и миелина, потере предшественников олигодендроцитов, зрелых олигодендроцитов и нейронов (12). Патофизиологическая роль воспаления подтверждена некоторыми клиническими исследованиями, показывающими повышение уровней цитокинов и хемокинов в сыворотке крови у новорожденных с ишемическим повреждением головного мозга.Более того, считается, что сверхэкспрессия воспалительных молекул может быть связана как с церебральным повреждением, так и с прогнозом (13-15).
Специфический вклад различных типов клеток в воспаление головного мозга, а также растворимых медиаторов воспалительного ответа при ГИЭ продолжает оставаться в центре внимания многих исследований в последние годы (7, 8, 16–19). Этот обзор содержит краткое изложение современных знаний о механизмах воспалительной реакции, участвующих в остром повреждении HI развивающегося мозга.Мы также обсуждаем противовоспалительный потенциал некоторых фармакологических агентов.
470″> Микроглия / макрофаги
Воспалительная реакция на гипоксию-ишемию головного мозга вызывается в основном микроглиальными клетками. В физиологических условиях в центральной нервной системе микроглия существует в разветвленном состоянии, которое ранее считалось «покоящейся» формой. Позже в этих клетках возникают очень подвижные процессы, которые активно наблюдают за их средой, постоянно ощущая изменения в микросреде и, таким образом, способны поддерживать гомеостаз ЦНС (20–22).В ответ на неонатальный HI разветвленная микроглия размножается и постепенно превращается в реактивные клетки. Этот процесс обычно называют активацией микроглии и проходит через несколько этапов, характеризующихся изменениями клеточной морфологии, размера клеток, количества клеток и экспрессии белков клеточной поверхности. На первом этапе активации микроглии эти клетки становятся гипертрофическими (часто называемыми активированной микроглией), увеличиваются, гиперразветвлены или имеют короткие толстые отростки. Они также изменяют экспрессию различных ферментов и рецепторов и начинают вырабатывать молекулы иммунного ответа.Наконец, микроглия теряет свою разветвленную морфологию и режим наблюдения и превращается в амебоидные функциональные клетки с увеличенным телом и небольшими отростками или их отсутствием (23, 24). Активные микроглиальные клетки мигрируют к месту повреждения и действуют совместно с рекрутированными моноцитами / макрофагами, вызывая иммунный ответ (рис. 1). Оба типа клеток играют важную роль в провоспалительной цитотоксической реакции, по крайней мере, на начальной стадии после инсульта (5–7, 25–27). В соответствии с этим существует огромное количество экспериментальных доказательств того, что снижение активации микроглии связано с уменьшением повреждения головного мозга (28, 29).Тем не менее, также известно, что воспалительные сигналы являются важным врожденным механизмом, ответственным за устранение патогенов и мусора, и помогают в восстановлении тканей, поддерживая нейрогенез после острого повреждения мозга. Таким образом, полное подавление активности микроглии может привести к более обширному повреждению головного мозга после ишемического повреждения (30, 31). Не так давно было обнаружено, что в зависимости от сигналов окружающей микросреды клетки микроглии способны приобретать различные фенотипы, представляющие различные состояния активации и различные способы действия.Фенотип микроглии был классифицирован Колтоном (32) как провоспалительный M1 (так называемый «больной») или противовоспалительный M2 (так называемый «здоровый»). Провоспалительный фенотип M1 способствует выработке и высвобождению медиаторов воспаления (цитокинов, хемокинов, ROS, NO, матриксных металлопротеиназ), которые в совокупности вызывают гибель олигодендроцитов и нейронов (24, 33, 34). В отличие от действия M1, M2 проявляет как иммуносупрессивные, так и нейропротекторные свойства за счет высвобождения противовоспалительных, а также нейротрофических факторов (таких как IGF, трансформирующий фактор роста [TGFβ], GDNF и IL-10), которые способствуют ангиогенезу, ремоделирование тканей и нейроремонт (32, 35–41).Исследования мозга взрослых при ишемии на животных показывают, что на ранних стадиях ишемического инсульта локальная микроглия и вновь рекрутированные макрофаги принимают фенотип M2, но позже трансформируются в M1, который вызывает воспалительный и цитотоксический ответ (33, 42). В соответствии с этим остаются наши недавние результаты, показывающие большое количество микроглиальных клеток M1 со значительно уменьшенным количеством клеток, представляющих фенотип M2 после неонатального HI (43). Переход сопровождается экспрессией новых поверхностных антигенов и производством медиаторов, специфичных для фенотипа.Для подтверждения роли реакции микроглии на HI в развивающемся мозге, в частности, изменения во времени поляризации фенотипа M2 на M1 и наоборот, необходимы дальнейшие исследования. Тем не менее, кажется логичным заявить, что эффективная терапия ишемии должна быть смещена с усилий, направленных на уменьшение количества микроглии / макрофагов, на регулирование равновесия между ответами обоих фенотипов микроглии / макрофагов.
РИСУНОК 1
Воспалительная реакция на гипоксию-ишемию.В ответ на гипоксию-ишемию покоящаяся / разветвленная микроглия пролиферирует и активируется. На первом этапе микроглия становится гипертрофированной, увеличенной и гиперразветвленной, а затем превращается в амебоидные клетки. При интенсивных острых сигналах эти клетки продуцируют провоспалительные агенты (в том числе цитокины и активные формы кислорода), которые вызывают нарушение незрелого гематоэнцефалического барьера (ГЭБ). В результате периферические иммунные клетки (нейтрофилы, моноциты, лимфоциты) проникают в мозг, что приводит к обострению воспаления и повреждению нейронов.
РИСУНОК 1
Воспалительная реакция на гипоксию-ишемию. В ответ на гипоксию-ишемию покоящаяся / разветвленная микроглия пролиферирует и активируется. На первом этапе микроглия становится гипертрофированной, увеличенной и гиперразветвленной, а затем превращается в амебоидные клетки. При интенсивных острых сигналах эти клетки продуцируют провоспалительные агенты (в том числе цитокины и активные формы кислорода), которые вызывают нарушение незрелого гематоэнцефалического барьера (ГЭБ). В результате периферические иммунные клетки (нейтрофилы, моноциты, лимфоциты) проникают в мозг, что приводит к обострению воспаления и повреждению нейронов.
477″> нейтрофилов
Существует множество исследований головного мозга взрослых, которые подтверждают гипотезу рекрутирования нейтрофилов как важного фактора развития ишемического повреждения головного мозга (50, 51).По сравнению со взрослыми новорожденные демонстрируют пониженную способность вызывать нейтрофильный ответ. Было обнаружено, что инвазия нейтрофилов в поврежденную ткань мозга после HI ограничена, и опубликованные результаты противоречивы (4, 52). Тем не менее нейтрофилы были обнаружены в кровеносных сосудах в течение первых нескольких часов после HI (4, 53). Более того, истощение нейтрофилов (нейтропения) перед HI снижает отек мозга (53), тогда как удаление циркулирующих нейтрофилов через 4-8 часов после HI не вызывает никакого улучшения (54).Кроме того, ингибирование НАДФН, необходимого для фагоцитоза нейтрофилами, также не обеспечивает нейропротекции у новорожденных мышей (55). Кроме того, он не изменяет передачу сигналов хемокинов и нейтрофилов, путь, который проявляет защитную способность против инсульта у взрослых крыс. Хотя вклад нейтрофилов в инсульт у взрослых грызунов доказан, их участие в повреждении головного мозга новорожденных еще не установлено.
481″> ПОСРЕДНИКИ ВОСПАЛЕНИЯ484″> ИЛ-1β
IL-1β широко признан одним из основных регуляторов как ранних, так и поздних стадий повреждения мозга, связанного с воспалением после гипоксических и ишемических повреждений (72–76). Несколько исследований демонстрируют, что неонатальная гипоксия-ишемия приводит к быстрому и устойчивому увеличению экспрессии мРНК и белка IL-1β (43, 56, 77–79) в поврежденном ипсилатеральном полушарии по сравнению с фиктивным контролем.Повышенный уровень IL-1β также наблюдался при более длительном времени реперфузии (6 и 14 дней). Такой отсроченный ответ предполагает продолжающееся воспаление, которое может привести к необратимому повреждению нейронов (78, 80). Стоит отметить, что, хотя считается, что IL-1β нетоксичен для клеток линии олигодендроцитов, он может останавливать пролиферацию и, как следствие, задерживать развитие белого вещества и восстановление после повреждения (81). Считается, что IL-1β действует главным образом за счет активации транскрипции гена iNOS (82) и генерации NO (83, 84), что может усугубить повреждение головного мозга.В подтверждение этого вредного действия IL-1β было показано, что введение либо антагониста рецептора интерлейкина I типа (IL-R1), либо блокирующих антител уменьшает повреждение, вызванное эксайтотоксичностью и / или ишемией (79, 85, 86). Благоприятный эффект, связанный с понижающей регуляцией IL-1β, включает ингибирование активации микроглии, инфильтрации нейтрофилов и снижение уровней цитокинов. Важно знать, что нокдаун IL-1β лентивирусом in vivo может обратить вспять набухание клеток, отек мозга и нарушения неврологической функции, вызванные HI у новорожденных (87).Таким образом, есть соблазн предположить, что цитокин IL-1β может быть мишенью для генной терапии новорожденных, страдающих HI.
488″> Ил-18
IL-18 представляет собой провоспалительный цитокин из семейства IL-1, который становится активным при расщеплении каспазой-1 аналогично тому, как это происходит для IL-1β. IL-18 преимущественно продуцируется активированной микроглией и астроцитами. Его экспрессия увеличивается после неонатального HI (80). Было обнаружено, что этот цитокин играет важную роль в развитии повреждения белого вещества (90).Генетическая делеция этого цитокина, по-видимому, является нейропротекторной при неонатальном повреждении HI, демонстрируя более высокую экспрессию основного белка миелина после повреждения по сравнению с мышами дикого типа. Интересно, что элиминация IL-18 более эффективно защищает мозг новорожденного от HI, чем генетический нокаут IL-1β (80).
492″> Ил-10
IL-10, как и IL-4, обычно считается противовоспалительным цитокином. Его уровень заметно увеличивается после HI (77). Противовоспалительное и защитное действие ИЛ-10 против гибели нейронов после экспериментального ГИ у новорожденных было отмечено только в том случае, когда экзогенный цитокин вводился после инсульта, тогда как лечение до или во время повреждения оказалось неэффективным. Более того, использование либо антител к IL-10, либо мышей, нокаутированных по IL-10, не продемонстрировало какого-либо положительного эффекта (92).Предполагается, что IL-10 может обратить вспять повреждение новорожденных, вызванное IL-1β, TNF-α и IL-6 (92). Наиболее вероятной и совместимой с уже установленной функцией IL-10 является его способность уменьшать накопление макрофагов в поврежденном мозге.
496″> IFNγ
Хотя количество доказательств важности IFNγ в развитии нейронов растет, имеются лишь ограниченные данные о роли этого цитокина после HI. Согласно существующим знаниям IFNγ, происходящий из активированных макрофагов / микроглии и реактивных астроцитов, может координировать клеточные иммунные и воспалительные реакции в центральной нервной системе посредством индукции и взаимодействия с другими цитокинами (100).Следовательно, кажется логичным предвидеть его двойную роль (защитную и деструктивную), обе из которых тесно связаны с уровнем и временем его проявления. Было обнаружено, что уровень этого цитокина в пуповинной крови повышается от 6 до 72 часов после рождения в случаях повреждения белого вещества при перинатальной травме головного мозга человека (101, 102). Известно, что IFNγ активирует макрофаги / микроглию для производства других провоспалительных цитокинов, таких как TNFα и интерлейкины (103), и, таким образом, участвует в индуцированной цитокинами токсичности для развивающихся олигодендроцитов в перинатальном мозге человека (103).Молекулярный механизм его действия включает образование АФК и перекисное окисление липидов, что приводит к токсическому повреждению (102). С другой стороны, представленные данные указывают на важную роль IFNγ в развитии нервной системы, в выживании нейронов, дифференцировке и росте процессов, а также в образовании миелина. Было даже предположено, что IFNγ потенциально защищает мозг от ишемического повреждения, уменьшая апоптоз в предшественниках олигодендроцитов (104) и астроцитах (92) грызунового происхождения. Таким образом, данные о роли IFNγ, представленные до сих пор, противоречивы и требуют дальнейшего подробного изучения.
500″> Хемокины
Хемокины представляют собой семейство небольших белков (8-10 кДа), принадлежащих к 4 классам: C, CC, CXC и CXC3, в зависимости от положения ключевых остатков цистеина. Несмотря на количество сообщений, посвященных роли цитокинов, в частности роли IL-1β, имеется лишь немного данных о потенциальной роли хемокинов в развитии ГИЭ (109, 110).Было обнаружено, что экспрессия мРНК некоторых хемокинов, таких как макрофагальный воспалительный белок-1 (MIP-1α и MIP-1β), предшествует проникновению иммунных клеток в мозг, что доказывает их значимость в воспалительной реакции (4). Экспрессия другого хемокина, белка хемоаттрактанта макрофагов (MCP) -1 / CCL2, а также его рецептора CCR2 также увеличивается после HI и эксайтотоксического повреждения в головном мозге новорожденных. Предполагается, что эти молекулы могут регулировать рекрутирование и активацию микроглии во время инсульта в мозг, а также экстравазацию и трансмиграцию моноцитов при воспалительных условиях (111).Патофизиологическая роль MCP-1 в неонатальном повреждении головного мозга очевидна из экспериментов с использованием защиты путем функциональной инактивации MCP-1 после инсульта или истощения фермента, превращающего IL-1 (109, 112). Активность рецептора CCR2 может также обеспечивать иммуномодулирующие и защитные функции во время воспаления центральной нервной системы. Благоприятный эффект CCR2 может быть связан с его участием в миграции нейробластов в поврежденную область мозга.
Было проведено всего несколько исследований, чтобы прояснить участие хемокинов CXC в перинатальном HI.Значительно повышенное количество хемокина CXCL10 (IP10) наблюдалось в начале ипсилатерального полушария по сравнению с контролем. Концентрация хемокина оставалась повышенной до 6 дней выживания. Напротив, уровень этих молекул на контралатеральной стороне не отличался от контроля (43). Данные, представленные Donega et al (113), показывают значительную повышающую регуляцию экспрессии гена CXCL10 после неонатальной HI. Предполагается, что CXCL10 может играть важную роль в регулировании хоминга мезенхимальных стволовых клеток в месте поражения.Таким образом, возникает вопрос, может ли иммуномодулирующее вмешательство оказывать негативное влияние на определенные аспекты нейрогенеза и, следовательно, на регенерацию мозга.
Фактор-1, происходящий из стромальных клеток (SDF-1) (CXCL12), является еще одним хемокином CXC, который может играть важную роль в перемещении стволовых клеток в области ишемического повреждения (114). Более того, SDF-1 считается полезным медиатором восстановления мозга за счет усиления нейрогенеза после ишемии у взрослых грызунов (115). Однако длительной активации этого цитокина у новорожденных не наблюдалось.
506″> Фактор транскрипции NF-κB
Фактор транскрипции ядерная каппа B, активированная в головном мозге новорожденного после гипоксически-ишемического инсульта, увеличивает транскрипцию нескольких основных генов, участвующих в воспалении, таких как провоспалительные цитокины, хемокины, TNF-α, молекулы адгезии и индуцируемые NOS (120, 121) , что может способствовать повреждению нейронов. Принято считать, что ингибирование NF-κB предотвращает продукцию провоспалительных цитокинов, тем самым способствуя нейропротекции (122, 123).
С другой стороны, NF-κB может активировать некоторые антиапоптотические факторы (Bcl-2 и Bcl-XL), увеличивать экспрессию нейротрофинов (например, фактора роста нервов [NGF]) и SOD и тем самым способствовать выживанию клеток (124 , 125). Согласно интересным результатам, представленным Nijboer et al (126), оказывается, что NF-κB может играть зависящую от времени специфическую роль: ранняя постинсультная активация NF-κB способствует повреждению головного мозга у новорожденных, тогда как позднее действие этого фактора способствует нейрональному повреждению. выживание за счет активации антиапоптотических молекул.
511″> Противовоспалительные стратегии и нейрозащита
Обычно считается, что блокирование воспалительной реакции обеспечивает нейрозащиту и имеет потенциал для использования в клиническом лечении ишемического повреждения головного мозга (65–67, 132, 133).Множество лекарств, направленных на нейровоспаление, были протестированы на животных моделях перинатального повреждения головного мозга, однако их перенос со скамьи на место у постели больного был ограничен. Прежде всего, важным соображением была доставка через гематоэнцефалический барьер. Однако альтернативные методы доставки, такие как наночастицы, способствуют нацеливанию на воспалительную систему (134–136). Широко известно, что большинство испытанных лекарств обладают множественными или даже плейотропными эффектами, которые выходят за рамки чисто противовоспалительного действия, включая антиоксидантные и антиапоптотические свойства и индукцию нейро- или ангиогенеза.Таким образом, трудно однозначно связать нейропротекторные свойства этих препаратов с их противовоспалительными свойствами. Хотя во многих, но не во всех случаях, защита связана с уменьшением плотности макрофагов в поврежденных областях, во все большем числе случаев защита осуществляется через антиапоптотический механизм, не влияя напрямую на активацию воспалительных путей, таких как цитокин или NO. для миноциклина (137–139), ингибитора iNOS 2-иминобиотина (140), хлорохина (29) и аминогуанидина (141).Таким образом, необходима значительная работа, чтобы понять взаимосвязь между повреждением, гибелью нейрональных клеток и воспалением. Поскольку HIE – очень разнородный и сложный процесс, поиск идеального метода для изучения этих взаимодействий остается сложной задачей. Несмотря на то, что несколько моделей гипоксии-ишемии были разработаны у грызунов и у более крупных видов [см. Обзор (142)], очевидно, что ни одна из них не может в достаточной степени имитировать сложную патофизиологию человека. Хотя биологическая близость к людям кажется важной в исследованиях на животных, эксперименты в целом проводились на крысах и мышах.Стоит отметить, что физиология грызунов и соотношение белого и серого вещества отличается от такового у человека. Другой проблемой является определение надлежащей дозы, режима и времени применения лекарств, поскольку терапевтические цели могут чередоваться в фазах гипоксически-ишемической энцефалопатии в дополнение к изменениям физиологического развития, которые происходят у новорожденных с течением времени (143). Прогрессивные исследования могут улучшить и оптимизировать будущее лечение, требуя индивидуального клинического фармакологического и физиологического понимания.
515″> Мелатонин
Мелатонин имеет несколько целей в каскаде повреждений и является идеальным кандидатом для снятия воспаления. Предполагается, что в дополнение к своему антиоксидантному действию и улавливанию свободных радикалов мелатонин также обладает противовоспалительными свойствами, предотвращая активацию и транслокацию NF-κB в ядро и заметно снижая активацию микроглии (152, 153). Исследование на поросятах показало, что мелатонин в сочетании с гипотермией значительно улучшает сохранение функции мозга и снижает гибель клеток.Хотя мелатонин кажется безопасным и не вызывает серьезных побочных эффектов, единого мнения об оптимальной дозировке нет (154). Этот вопрос все еще продолжается (NCT02621944).
519″> Миноциклин
Миноциклин – это производное тетрациклина, которое, как было доказано, является безопасным и эффективным в качестве противовоспалительного препарата для лечения воспалительных состояний.К сожалению, было показано, что миноциклин оказывает различное и даже пагубное воздействие на разные виды и модели неврологических расстройств (29, 157–159). Миноциклин не одобрен для использования у новорожденных из-за значительного побочного эффекта (156, 160).
523″> Циклооксигеназы (ЦОГ-2)
В настоящее время селективные ингибиторы ЦОГ-2 превратились в важный класс лекарств из-за меньшей частоты побочных эффектов по сравнению с некоторыми нестероидными противовоспалительными препаратами.Кроме того, применяемый в клинике ингибитор ЦОГ-2 целекоксиб быстро выводится из употребления у детей по сравнению со взрослыми (166). Исследования, опубликованные Fathali et al (131), показывают, что лечение ингибитором ЦОГ-2 NS-10 оказывает нейропротекторное действие на модели неонатальной гипоксии-ишемии. Это приводит к заметному снижению инфильтрации воспалительных клеток, таких как макрофаги и нейтрофилы, и к более низкой активации микроглии, а также к экспрессии IL-6 в поврежденной ткани мозга. Таким образом, селективные ингибиторы ЦОГ-2 можно рассматривать как один из ценных вариантов лечения.
527″> Ингибиторы гистон-деацетилазы
Растущее количество доказательств указывает на то, что ингибиторы гистоновых деацетилаз (HDAC) широкого действия являются противовоспалительными агентами. Ранние исследования показали, что ингибиторы HDAC, такие как трихостатин А (TSA) и фенилбутират, модулируют экспрессию воспалительных генов, участвующих в патогенезе экспериментального ревматоидного артрита (172).Противовоспалительное и нейрозащитное действие ингибиторов HDAC (TSA, бутират натрия, вальпроевая кислота) было позже описано в ишемизированном мозге взрослого человека (173–175). Несколько доступных отчетов касались их противовоспалительного действия при гипоксии-ишемии, пораженной незрелым мозгом (11, 26). Оказалось, что нейропротекторное действие ингибиторов HDAC является многосторонним и включает модуляцию окислительных путей и компонентов эксайтотоксичности, снижение ряда воспалительных и проапоптотических факторов.Широкое действие ингибиторов HDAC затрудняет определение того, какая изоформа фермента HDAC особенно важна для воспаления. Поскольку неонатальное повреждение головного мозга HI является сложным и нацеливания только на один механизм далеко не достаточно, в будущем следует рассмотреть вопрос об изучении сроков, дозировок и путей введения лекарств, а также о проведении функциональных исследований. Таким образом, можно предположить перспективность плейотропного действия ингибиторов HDAC. Кроме того, продолжают выявляться новые противовоспалительные иммуномодулирующие соединения, которые вселяют большие надежды на их использование в качестве терапевтического варианта у младенцев с энцефалопатией HI (69, 70).
531″> ССЫЛКИ
1Ferriero
DM.
Неонатальная черепно-мозговая травма
.N Engl J Med
2004
;351
:1985
–95
2Calvert
JW
,Zhang
JH.
Патофизиология гипоксически-ишемического инсульта в перинатальном периоде
.Neurol Res
2005
;27
:246
–60
3Perlman
JM.
Сводные материалы группы неврологов по гипоксически-ишемической энцефалопатии
.Педиатрия
2006
;117 (Приложение 1)
:S28
–33
4Bona
E
,Andersson
A-L
,Blomgren
K
и др.Хемокины и реакция воспалительных клеток на гипоксию-ишемию у неполовозрелых крыс
.Pediatr Res
1999
;45
:500
–9
5Джин
Y
,Silverman
AJ
,Vannucci
SJ.
Тучные клетки являются ранними ответчиками после гипоксии-ишемии в головном мозге незрелых крыс
.Инсульт
2009
;40
:3107
–12
6Hagberg
H
,Gressens
P
,Mallard
C.
Воспаление во время жизни плода и новорожденного: последствия для неврологических и психоневрологических заболеваний у детей и взрослых
.Ann Neurol
2012
;71
:444
–57
7Hagberg
H
,Mallard
C
,Ferriero
DM
и др.Роль воспаления в перинатальной травме головного мозга
.Nat Rev Neurol
2015
;11
:192
–208
8Liu
F
,McCullough
LD.
Воспалительные реакции при гипоксической ишемической энцефалопатии
.Acta Pharmacol Sin
2013
;34
:1121
–30
9Winerdal
M
,Winerdal
ME
,Kinn
J
и др.Длительное местное и системное воспаление после гипоксической ишемии головного мозга у новорожденных мышей
.PLoS One
2012
;7
:e36422
10Algra
SO
,Groeneveld
KM
,Schadenberg
AWL
и др.Ишемия головного мозга вызывает немедленный врожденный иммунный ответ у новорожденных во время кардиохирургии
.J Нейровоспаление
2013
;10
:24
11Ziemka-Nalecz
M
,Jaworska
J
,Sypecka
J
и др.Бутират натрия, ингибитор гистондеацетилазы, проявляет нейропротекторные / нейрогенные эффекты на модели неонатальной гипоксии-ишемии на крысах
.Mol Neurobiol
2016
30 августа [epub перед печатью] 12Yong
VW
,Marks
S.
Взаимодействие между иммунной и центральной нервной системами при повреждении нейронов
.Неврология
2010
;74
:S9
–16
13Левитон
A
,Dammann
O.
Коагуляция, воспаление и риск повреждения белого вещества новорожденных
.Pediatr Res
2004
;55
:541
–5
14Нельсон
КБ
,Grether
JK.
Потенциально удушающие состояния и спастический церебральный паралич у младенцев с нормальной массой тела при рождении
.Am J Obstet Gynecol
1998
;179
:507
–13
15Али
H
,Хашаба
MT
,Эль-Аюти
M
и др.IL-1beta, IL-6 и TNF-alpha и исходы неонатальной гипоксической ишемической энцефалопатии
.Brain Dev
2006
;28
:178
–82
16Бхалала
США
,Келер
RC
,Каннан
S.
Нейровоспаление и нейроиммунная дисрегуляция после острого гипоксически-ишемического повреждения развивающегося мозга
.Передний педиатр
2014
;2
:144
17Bonestroo
HJC
,Heijnen
CJ
,Groenendaal
F
и др.Развитие повреждения серого и белого вещества головного мозга и воспаления головного мозга с течением времени после воспалительной перинатальной асфиксии
.Dev Neurosci
2015
;37
:78
–94
18Fleiss
B
,Chhor
V
,Rajudin
N
и др.Противовоспалительное действие небольшой молекулы пифитрина-µ на микроглию BV2
.Dev Neurosci
2015
;37
:363
–75
19Джин
C
,Londono
I
,Mallard
C
и др.Новые средства для оценки воспалительного повреждения головного мозга новорожденных
.J Нейровоспаление
2015
;12
:180
20Nimmerjahn
A
,Kirchhoff
F
,Helmchen
F.
Покоящиеся клетки микроглии являются высокодинамичными наблюдателями паренхимы головного мозга in vivo
.Science
2005
;308
:1314
–8
21Davalos
D
,Grutzendler
J
,Yang
G
и др.АТФ опосредует быстрый ответ микроглии на локальное повреждение головного мозга in vivo
.Nat Neurosci
2005
;8
:752
–8
22Haynes
SE
,Hollopeter
G
,Ян
G
и др.Рецептор P2Y12 регулирует активацию микроглии внеклеточными нуклеотидами
.Nat Neurosci
2006
;9
:1512
–9
23Kettenmann
H
,Hanisch
U-K
,Noda
M
и др.Физиология микроглии
.Physiol Rev
2011
;91
:461
–553
24Бош
D
,Perry
VH
,Nicoll
J. a R.
Обзор: паттерны активации микроглии и их идентификация в мозге человека
.Neuropathol Appl Neurobiol
2013
;39
:3
–18
25Tsuji
M
,Higuchi
Y
,Shiraishi
K
и др.Защитный эффект аминогуанидина при гипоксически-ишемическом повреждении головного мозга и временной профиль оксида азота в головном мозге у новорожденных крыс
.Pediatr Res
2000
;47
:79
–83
26Fleiss
B
,Nilsson
MKL
,Blomgren
K
и др.Нейропротекция ингибитором гистондеацетилазы трихостатином А на модели сенсибилизированного липополисахаридом неонатального гипоксически-ишемического повреждения головного мозга
.J Нейровоспаление
2012
;9
:70
27Vannucci
RC
,Vannucci
SJ.
Перинатальное гипоксически-ишемическое повреждение головного мозга: эволюция модели на животных
.Dev Neurosci
2005
;27
:81
–6
28Arvin
KL
,Han
BH
,Du
Y
и др.Миноциклин заметно защищает мозг новорожденного от гипоксически-ишемического повреждения
.Ann Neurol
2002
;52
:54
–61
29Dommergues
M-A
,Plaisant
F
,Verney
C
и др.Ранняя активация микроглии после неонатального эксайтотоксического повреждения мозга у мышей: потенциальная мишень для нейрозащиты
.Neuroscience
2003
;121
:619
–28
30Lalancette-Hébert
M
,Gowing
G
,Simard
A
и др.Избирательное удаление пролиферирующих клеток микроглии усугубляет ишемическое повреждение головного мозга
.J Neurosci
2007
;27
:2596
–605
31Faustino
СП
,Wang
X
,Johnson
CE
и др.Клетки микроглии участвуют в эндогенной защите мозга после острого неонатального очагового инсульта
.J Neurosci
2011
;31
:12992
–3001
32Colton
CA.
Неоднородность активации микроглии при врожденном иммунном ответе в головном мозге
.J Neuroimmune Pharmacol
2009
;4
:399
–418
33Hu
X
,Li
P
,Guo
Y
и др.Динамика поляризации микроглии / макрофагов раскрывает новый механизм распространения повреждений после очаговой церебральной ишемии
.Stroke J Cereb Circ
2012
;43
:3063
–70
34Hu
X
,Leak
RK
,Shi
Y
и др.Поляризация микроглии и макрофагов – новые перспективы восстановления мозга
.Nat Rev Neurol
2015
;11
:56
–64
35Кройцберг
ГВт.
Microglia: датчик патологических событий в ЦНС
.Trends Neurosci
1996
;19
:312
–8
36Ekdahl
CT
,Kokaia
Z
,Lindvall
O.
Воспаление мозга и нейрогенез у взрослых: двойная роль микроглии
.Neuroscience
2009
;158
:1021
–9
37Бутовский
O
,Ziv
Y
,Schwartz
A
и др.Микроглия, активированная IL-4 или IFN-гамма, по-разному индуцирует нейрогенез и олигодендрогенез из взрослых стволовых клеток / клеток-предшественников
.Mol Cell Neurosci
2006
;31
:149
–60
38Krady
JK
,Lin
H-W
,Liberto
CM
и др.Цилиарный нейротрофический фактор и интерлейкин-6 по-разному активируют микроглию
.J Neurosci Res
2008
;86
:1538
–47
39Schwartz
M
,Butovsky
O
,Brück
W
и др.Фенотип микроглии: обратима ли приверженность?
Trends Neurosci
2006
;29
:68
–74
40Hanisch
U-K.
Микроглия как источник и мишень цитокинов
.Glia
2002
;40
:140
–55
41Блок
ML
,Zecca
L
,Hong
J-S.
Нейротоксичность, опосредованная микроглией: раскрытие молекулярных механизмов
.Nat Rev Neurosci
2007
;8
:57
–69
42Perego
C
,Fumagalli
S
,De Simoni
M-G.
Временной паттерн экспрессии и совместная локализация маркеров фенотипа микроглии / макрофагов после ишемического повреждения головного мозга у мышей
.J Нейровоспаление
2011
;8
:174
43Яворска
J
,Ziemka-Nalecz
M
,Sypecka
J
и др.Потенциальная нейрозащитная роль ингибитора гистондеацетилазы, бутирата натрия, после гипоксии-ишемии новорожденных
.J Нейровоспаление
2017
;14
:34
44Sen
E
,Levison
SW.
Астроциты и нарушения развития белого вещества
.Ment Retard Dev Disabil Res Ред.
2006
;12
:97
–104
45Салливан
SM
,Björkman
ST
,Miller
SM
и др.Морфологические изменения астроцитов белого вещества в ответ на гипоксию / ишемию у новорожденных свиней
.Brain Res
2010
;1319
:164
–74
46Sofroniew
MV.
Астроциты, препятствующие нейротоксическому воспалению
.Nat Rev Neurosci
2015
;16
:249
–63
47Росси
DJ
,Brady
JD
,Mohr
C.
Метаболизм астроцитов и передача сигналов при ишемии головного мозга
.Nat Neurosci
2007
;10
:1377
–86
48Takano
T
,Oberheim
N
,Cotrina
ML
и др.Астроциты и ишемическое повреждение
.Инсульт
2009
;40
:S8
–12
49Gabel
S
,Koncina
E
,Dorban
G
и др.Воспаление способствует превращению астроцитов в нервные клетки-предшественники посредством активации NF-κB
.Мол нейробиол
2016
;53
:5041
–55
50Garcia
JH
,Liu
KF
,Yoshida
Y
и др.Приток лейкоцитов и тромбоцитов в развивающийся инфаркт головного мозга (крыса Wistar)
.Am J Pathol
1994
;144
:188
–99
51Shiga
Y
,Onodera
H
,Kogure
K
и др.Нейтрофил как медиатор образования ишемического отека в головном мозге
.Neurosci Lett
1991
;125
:110
–2
52Шривастава
K
,Chertoff
M
,Llovera
G
и др.Краткосрочный и долгосрочный анализ и сравнение нейродегенерации и воспалительного клеточного ответа в ипсилатеральном и контралатеральном полушарии головного мозга новорожденных мышей после гипоксии / ишемии
.Neurol Res Int
2012
;2012
:781512
53Hudome
S
,Palmer
C
,Робертс
RL
и др.Роль нейтрофилов в производстве гипоксически-ишемического повреждения головного мозга у новорожденных крыс
.Pediatr Res
1997
;41
:607
–16
54Палмер
C
,Робертс
RL
,Young
PI.
Время истощения нейтрофилов влияет на долгосрочную нейрозащиту у новорожденных крыс с гипоксически-ишемическим повреждением головного мозга
.Pediatr Res
2004
;55
:549
–56
55Доверхаг
C
,Keller
M
,Karlsson
A
и др.Фармакологическое и генетическое ингибирование НАДФН-оксидазы не снижает повреждения головного мозга в различных моделях перинатального повреждения головного мозга у новорожденных мышей
.Neurobiol Dis
2008
;31
:133
–44
56Jin
Y
,Silverman
A-J
,Vannucci
SJ.
Стабилизация тучных клеток ограничивает гипоксически-ишемическое повреждение головного мозга у неполовозрелых крыс
.Dev Neurosci
2007
;29
:373
–84
57Hedtjärn
M
,Mallard
C
,Hagberg
H.
Профилирование воспалительных генов в развивающемся мозге мыши после гипоксии-ишемии
.J Cereb Blood Flow Metab
2004
;24
:1333
–51
58Dammann
O
,O’Shea
TM.
Цитокины и перинатальное поражение головного мозга
.Клин Перинатол
2008
;35
:643
–63
59Арвин
B
,Невилл
LF
,Barone
FC
и др.Роль воспаления и цитокинов в черепно-мозговой травме
.Neurosci Biobehav Rev
1996
;20
:445
–52
60Ван
X
,Feuerstein
GZ.
Роль иммунных и воспалительных медиаторов в повреждении ЦНС
.Drug News Perspect
2000
;13
:133
–40
61Чалак
LF
,Санчес
PJ
,Адамс-Хуэт
B
и др.Биомаркеры тяжести неонатальной гипоксически-ишемической энцефалопатии и исходы у новорожденных, получающих терапию гипотермией
.J Педиатр
2014
;164
:468
–74
62Shalak
LF
,Laptook
AR
,Jafri
HS
и др.Клинический хориоамнионит, повышение цитокинов и повреждение головного мозга у доношенных детей
.Педиатрия
2002
;110
:673
–80
63Volpe
JJ.
Перинатальная травма головного мозга: от патогенеза к нейропротекции
.Ment Retard Dev Disabil Res Rev
2001
;7
:56
–64
64Роша-Феррейра
E
,Христова
М.
Противомикробные пептиды и комплемент при повреждении головного мозга, вызванном гипоксией-ишемией новорожденных
.Фронт Иммунол
2015
;6
:56
65Карти
ML
,Wixey
JA
,Colditz
PB
и др.Постинсультное лечение миноциклином снижает нейровоспаление и повреждение белого вещества, вызванное гипоксией-ишемией, у новорожденных крыс: сравнение двух различных режимов дозирования
.Int J Dev Neurosci
2008
;26
:477
–85
66Chew
L-J
,Takanohashi
A
,Bell
M.
Микроглия и воспаление: влияние на травмы головного мозга, связанные с развитием
.Ment Retard Dev Disabil Res Ред.
2006
;12
:105
–12
67McRae
A
,Gilland
E
,Bona
E
и др.Активация микроглии после гипоксической ишемии новорожденных
.Brain Res Dev Brain Res
1995
;84
:245
–52
68Фернандес-Лопес
D
,Faustino
J
,Derugin
N
и др.Уменьшение размера инфаркта и накопления микроглии у крыс, получавших WIN 55,212-2, после неонатального инсульта
.Neuroscience
2012
;207
:307
–15
69Альварес
FJ
,Лафуэнте
H
,Рей-Сантано
MC
и др.Нейропротекторные эффекты непсихоактивного каннабиноида каннабидиола у новорожденных поросят с гипоксически-ишемией
.Pediatr Res
2008
;64
:653
–8
70Тан
M
,Александр
H
,Clark
RSB
и др.Миноциклин снижает гибель нейронов и ослабляет реакцию микроглии после остановки сердца при асфиксии у детей
.J Cereb Blood Flow Metab
2010
;30
:119
–29
71Шен
H
,Ху
X
,Лю
C
и др.Этилпируват защищает от гипоксически-ишемического повреждения головного мозга за счет антиклеточной гибели и противовоспалительных механизмов
.Neurobiol Dis
2010
;37
:711
–22
72Ямасаки
Y
,Мацуура
N
,Shozuhara
H
и др.Интерлейкин-1 как патогенетический медиатор ишемического поражения головного мозга крыс
.Инсульт
1995
;26
:676
–80
, обсуждение 68173Лю
J
,Feng
Z-C.
Повышенные уровни интерлейкина-1 бета в плазме пуповины коррелировали с неблагоприятными исходами неонатальной гипоксически-ишемической энцефалопатии
.J Trop Pediatr
2010
;56
:178
–82
74Long-Smith
CM
,Collins
L
,Toulouse
A
и др.Интерлейкин-1β способствует гибели дофаминергических нейронов, индуцированной липополисахаридной крысиной глией in vitro
.J Нейроиммунол
2010
;226
:20
–6
75Deng
Y
,Lu
J
,Sivakumar
V
и др.Амебоидная микроглия в перивентрикулярном белом веществе индуцирует повреждение олигодендроцитов за счет экспрессии провоспалительных цитокинов через сигнальный путь киназы MAP у гипоксических новорожденных крыс
.Brain Pathol
2008
;18
:387
–400
76Вентилятор
L-W
,Mitchell
HJ
,Tien
L-T
и др.Вызванное интерлейкином-1бета повреждение головного мозга новорожденных крыс может быть уменьшено с помощью альфа-фенил-н-трет-бутилнитрона
.Exp Neurol
2009
;220
:143
–53
77Bonestroo
HJC
,Nijboer
CHA
,van Velthoven
CTJ
и др.Воспалительная реакция мозга и печени после неонатальной гипоксии-ишемии у новорожденных крыс
.Dev Neurosci
2013
;35
:197
–211
78Сан
Y
,Calvert
JW
,Zhang
JH.
Гипоксия / ишемия новорожденных связана со снижением медиаторов воспаления после введения эритропоэтина
.Инсульт
2005
;36
:1672
–8
79Hagberg
H
,Gilland
E
,Bona
E
и др.Повышенная экспрессия интерлейкина (ИЛ) -1 и ИЛ-6 матричной РНК и биоактивного белка после гипоксии-ишемии у новорожденных крыс
.Pediatr Res
1996
;40
:603
–9
80Hedtjärn
M
,Leverin
A-L
,Eriksson
K
и др.Вовлечение интерлейкина-18 в гипоксически-ишемическое повреждение головного мозга
.J Neurosci
2002
;22
:5910
–9
81Vela
JM
,Molina-Holgado
E
,Arévalo-Martín
A
и др.Интерлейкин-1 регулирует пролиферацию и дифференцировку клеток-предшественников олигодендроцитов
.Mol Cell Neurosci
2002
;20
:489
–502
82Кадхим
H
,Табарки
B
,De Prez
C
и др.Интерлейкин-2 в патогенезе перинатального поражения белого вещества
.Неврология
2002
;58
:1125
–8
83Betz
AL
,Schielke
GP
,Yang
GY.
Интерлейкин-1 при ишемии головного мозга
.Кейо Дж. Мед
1996
;45
:230
–7
обсуждение 23884Bonmann
E
,Suschek
C
,Spranger
M
и др.Доминирующая роль экзогенного или эндогенного интерлейкина-1 бета на экспрессию и активность индуцибельной синтазы оксида азота в эндотелиальных клетках микрососудистого мозга крыс
.Neurosci Lett
1997
;230
:109
–12
85Relton
JK
,Rothwell
NJ.
Антагонист рецептора интерлейкина-1 подавляет ишемическое и эксайтотоксическое повреждение нейронов у крыс
.Brain Res Bull
1992
;29
:243
–6
86Loddick
SA
,Rothwell
NJ.
Нейропротекторные эффекты человеческого рекомбинантного антагониста рецептора интерлейкина-1 при очаговой ишемии головного мозга у крыс
.J Cereb Blood Flow Metab
1996
;16
:932
–40
87Лю
S
,Zhu
S
,Zou
Y
и др.Нокдаун IL-1β улучшает гипоксию-ишемию мозга, связанную с повышением регуляции IL-6 в клеточных и животных моделях
.Мол нейробиол
2015
;51
:743
–52
88Patkai
J
,Mesples
B
,Dommergues
MA
и др.Вредные эффекты IL-9-активированных тучных клеток и нейропротекция антигистаминными препаратами в развивающемся мозге мышей
.Pediatr Res
2001
;50
:222
–30
89Fontaine
RH
,Кейсы
O
,Lelièvre
V
и др.Передача сигналов рецептора IL-9 / IL-9 избирательно защищает кортикальные нейроны от апоптоза развития
.Cell Death Differ
2008
;15
:1542
–52
90Hedtjärn
M
,Mallard
C
,Arvidsson
P
и др.Повреждение белого вещества в незрелом мозге: роль интерлейкина-18
.Neurosci Lett
2005
;373
:16
–20
91Dommergues
MA
,Patkai
J
,Renauld
JC
и др.Провоспалительные цитокины и интерлейкин-9 усугубляют эксайтотоксические поражения новорожденных мышей neopallium
.Ann Neurol
2000
;47
:54
–63
92Mesples
B
,Plaisant
F
,Gressens
P.
Влияние интерлейкина-10 на неонатальные эксайтотоксические поражения головного мозга у мышей
.Brain Res Dev Brain Res
2003
;141
:25
–32
93Suzuki
S
,Tanaka
K
,Suzuki
N.
Амбивалентные аспекты интерлейкина-6 при ишемии головного мозга: воспалительные и нейротрофические аспекты
.J Cereb Blood Flow Metab
2009
;29
:464
–79
94Hama
T
,Kushima
Y
,Miyamoto
M
и др.H. Интерлейкин-6 улучшает выживаемость мезэнцефальных катехоламинергических и перегородочных холинергических нейронов постнатальных двухнедельных крыс в культурах
.Neuroscience
1991
;40
:445
–52
95Маэда
Y
,Мацумото
M
,Hori
O
и др.Опосредованная гипоксией / реоксигенацией индукция астроцитарного интерлейкина 6: паракринный механизм, потенциально повышающий выживаемость нейронов
.J Exp Med
1994
;180
:2297
–308
96Хирота
H
,Кияма
H
,Кишимото
T
и др.Ускоренная регенерация нервов у мышей за счет повышенной экспрессии интерлейкина (ИЛ) 6 и рецептора ИЛ-6 после травмы
.J Exp Med
1996
;183
:2627
–34
97Али
C
,Николь
O
,Docagne
F
и др.Интерлейкин-6, индуцированный ишемией, как потенциальный эндогенный нейропротекторный цитокин против опосредованной рецептором NMDA эксайтотоксичности в головном мозге
.J Cereb Blood Flow Metab
2000
;20
:956
–66
98Shioda
S
,Ozawa
H
,Dohi
K
и др.PACAP защищает нейроны гиппокампа от апоптоза: участие сигнального пути JNK / SAPK
.Ann N Y Acad Sci
1998
;865
:111
–7
99Szaflarski
J
,Burtrum
D
,Silverstein
FS.
Церебральная гипоксия-ишемия стимулирует экспрессию генов цитокинов у перинатальных крыс
.Инсульт
1995
;26
:1093
–100
100Popko
B
,Corbin
JG
,Baerwald
KD
и др.Влияние гамма-интерферона на центральную нервную систему
.Mol Neurobiol
1997
;14
:19
–35
101Hansen-Pupp
I
,Harling
S
,Berg
A-C
и др.Циркулирующий гамма-интерферон и поражение белого вещества головного мозга у недоношенных детей
.Pediatr Res
2005
;58
:946
–52
102Folkerth
RD
,Keefe
RJ
,Haynes
RL
и др.Экспрессия гамма-интерферона при перивентрикулярной лейкомаляции головного мозга человека
.Brain Pathol
2004
;14
:265
–74
103Балабанов
R
,Strand
K
,Kemper
A
и др.Супрессор экспрессии передачи сигналов цитокинов 1 защищает олигодендроциты от пагубных эффектов гамма-интерферона
.J Neurosci
2006
;26
:5143
–52
104Манн
SA
,Versmold
B
,Marx
R
и др.Кортикостероиды отменяют индуцированный цитокинами блок выживания и дифференцировки клеток-предшественников олигодендроцитов крыс
.J Нейровоспаление
2008
;5
:39
105Arnett
HA
,Mason
J
,Marino
M
и др.TNF-альфа способствует пролиферации предшественников олигодендроцитов и ремиелинизации
.Nat Neurosci
2001
;4
:1116
–22
106Fontaine
V
,Mohand-Said
S
,Hanoteau
N
и др.Нейродегенеративные и нейропротективные эффекты фактора некроза опухоли (TNF) при ишемии сетчатки: противоположные роли рецептора TNF 1 и рецептора TNF 2
.J Neurosci
2002
;22
:RC216 [База данных]
107Накадзава
T
,Накадзава
C
,Мацубара
A
и др.Фактор альфа некроза опухоли опосредует гибель олигодендроцитов и задержку потери ганглиозных клеток сетчатки на мышиной модели глаукомы
.J Neurosci
2006
;26
:12633
–41
108Deng
YY
,Lu
J
,Ling
E-A
и др.Произведенный из микроглии фактор, стимулирующий колонии макрофагов, способствует выработке провоспалительных цитокинов астроцитами перивентрикулярного белого вещества в гипоксическом мозге новорожденных
.Brain Pathol
2010
;20
:909
–25
109Galasso
JM
,Miller
MJ
,Cowell
RM
и др.Острое эксайтотоксическое повреждение индуцирует экспрессию хемоаттрактантного белка-1 моноцитов и его рецептора CCR2 в головном мозге новорожденных крыс
.Exp Neurol
2000
;165
:295
–305
110Galasso
JM
,Liu
Y
,Szaflarski
J
и др.Моноцитарный хемоаттрактантный белок-1 является медиатором острого эксайтотоксического повреждения головного мозга новорожденных крыс
.Neuroscience
2000
;101
:737
–44
111Чу
HX
,Арумугам
TV
,Gelderblom
M
и др.Роль CCR2 при воспалительных заболеваниях центральной нервной системы
.J Cereb Blood Flow Metab
2014
;34
:1425
–9
112Xu
H
,Баркс
JD
,Schielke
GP
и др.Ослабление индуцированной гипоксией-ишемией экспрессии хемоаттрактантного белка-1 моноцитов в головном мозге новорожденных мышей с дефицитом фермента, превращающего интерлейкин-1
.Brain Res Mol Brain Res
2001
;90
:57
–67
113Донега
V
,Nijboer
CH
,Braccioli
L
и др.Интраназальное введение человеческих МСК при ишемическом поражении мозга у мышей: нейрорегенеративные функции in vitro и in vivo
.PLoS One
2014
;9
:e112339
114Hill
WD
,Hess
DC
,Martin-Studdard
A
и др.SDF-1 (CXCL12) активируется в ишемической полутени после инсульта: связь с возвращением клеток костного мозга к повреждению
.J Neuropathol Exp Neurol
2004
;63
:84
–96
115Миллер
JT
,Бартли
JH
,Wimborne
HJC
и др.Экспрессия нейробластов и хемотаксического фактора ангиобластов SDF-1 (CXCL12) кратковременно усиливается реактивными астроцитами в головном мозге после гипоксически-ишемического повреждения новорожденных
.BMC Neurosci
2005
;6
:63
116Ferriero
DM
,Holtzman
DM
,Черный
SM
и др.Новорожденные мыши, лишенные нейрональной синтазы оксида азота, менее уязвимы к гипоксически-ишемическому повреждению
.Neurobiol Dis
1996
;3
:64
–71
117Iadecola
C
,Zhang
F
,Casey
R
и др.Отсроченное уменьшение ишемического повреждения мозга и неврологического дефицита у мышей, лишенных индуцибельного гена синтазы оксида азота
.J Neurosci
1997
;17
:9157
–64
118Huang
Z
,Huang
PL
,Ma
J
и др.Увеличенные инфаркты у мышей с нокаутом эндотелиальной синтазы оксида азота ослабляются нитро-1-аргинином
.J Cereb Blood Flow Metab
1996
;16
:981
–7
119Мерфи
S.
Производство оксида азота глиальными клетками: регуляция и потенциальная роль в ЦНС
.Glia
2000
;29
:1
–13
120Николс
TC.
NF-kappaB и реперфузионная травма
.Drug News Perspect
2004
;17
:99
–104
121Хайден
MS
,Ghosh
S.
Сигнализация NF-kappaB
.Genes Dev
2004
;18
:2195
–224
122Чанг
Y-C
,Хуан
C-C.
Перинатальное повреждение головного мозга и регуляция транскрипции
.Curr Opin Neurol
2006
;19
:141
–7
123Малкахи
Нью-Джерси
,Росс
Дж
,Ротвелл
Нью-Джерси
и др.Отсроченное введение антагониста рецепторов интерлейкина-1 защищает крыс от преходящей церебральной ишемии
.Br J Pharmacol
2003
;140
:471
–6
124Tamatani
M
,Mitsuda
N
,Matsuzaki
H
и др.Путь апоптоза нейронов, индуцированный гипоксией / реоксигенацией: роль ядерного фактора-каппаВ и Bcl-2
.J Neurochem
2000
;75
:683
–93
125Кассед
CA
,Виллинг
AE
,Гарбузова-Дэвис
S
и др.Недостаток NF-kappaB p50 усугубляет дегенерацию нейронов гиппокампа после химического воздействия и ухудшает обучаемость
.Exp Neurol
2002
;176
:277
–88
126Nijboer
CH
,Heijnen
CJ
,Groenendaal
F
и др.Двойная роль пути NF-kappaB в неонатальном гипоксически-ишемическом повреждении головного мозга
.Инсульт
2008
;39
:2578
–86
127Суманович-Гламузина
D
,Culo
F
,Culo
M-I
и др.Сосудорасширяющие простагландины при перинатальном гипоксическом поражении головного мозга
.Coll Antropol
2008
;32 (Дополнение 1)
:183
–7
128Андреассон
К.
Передача сигналов простагландина при церебральной ишемии
.Br J Pharmacol
2010
;160
:844
–6
129Taniguchi
H
,Anacker
C
,Suarez-Mier
GB
и др.Функция рецепторов простагландина E2 EP в остром исходе гипоксической ишемической энцефалопатии грызунов
.Neurosci Lett
2011
;504
:185
–90
130Нагаяма
M
,Нива
K
,Нагаяма
T
и др.Ингибитор циклооксигеназы-2 NS-398 облегчает ишемическое повреждение головного мозга у мышей дикого типа, но не у мышей с делецией гена индуцибельной синтазы оксида азота
.J Cereb Blood Flow Metab
1999
;19
:1213
–9
131Fathali
N
,Ostrowski
RP
,Lekic
T
и др.Ингибирование циклооксигеназы-2 обеспечивает длительную защиту от неонатального гипоксически-ишемического повреждения головного мозга
.Crit Care Med
2010
;38
:572
–8
132Tang
N-Y
,Liu
C-H
,Hsieh
C-T
и др.Противовоспалительное действие пеонифлорина при инфаркте головного мозга, вызванном ишемией-реперфузией, у крыс Sprague-Dawley
.Am J Chin Med
2010
;38
:51
–64
133Simão
F
,Matté
A
,Pagnussat
AS
и др.Предварительное кондиционирование ресвератрола модулирует воспалительную реакцию в гиппокампе крыс после глобальной церебральной ишемии
.Neurochem Int
2012
;61
:659
–65
134Navath
RS
,Kurtoglu
YE
,Wang
B
и др.Конъюгаты дендример-лекарственное средство для индивидуального внутриклеточного высвобождения лекарственного средства на основе уровней глутатиона
.Bioconjug Chem
2008
;19
:2446
–55
135Каннан
S
,Dai
H
,Navath
RS
и др.Послеродовая терапия на основе дендримеров при нейровоспалении и церебральном параличе на кролике, модель
.Sci Transl Med
2012
;4
:130ra46
136Балакришнан
B
,Nance
E
,Johnston
MV
и др.Наномедицина при церебральном параличе
.Int J Nanomedicine
2013
;8
:4183
–95
137Fox
C
,Dingman
A
,Derugin
N
и др.Миноциклин обеспечивает раннюю, но временную защиту незрелого мозга после очаговой церебральной ишемии-реперфузии
.J Cereb Blood Flow Metab
2005
;25
:1138
–49
138Tikka
T
,Fiebich
BL
,Goldsteins
G
и др.Миноциклин, производное тетрациклина, обладает нейропротективным действием против эксайтотоксичности, подавляя активацию и пролиферацию микроглии
.J Neurosci
2001
;21
:2580
–8
139Festoff
BW
,Ameenuddin
S
,Arnold
PM
и др.Миноциклин нейропротектор, уменьшает микроглиоз и подавляет экспрессию протеазы каспазы на ранней стадии после повреждения спинного мозга
.J Neurochem
2006
;97
:1314
–26
140van den Tweel
ERW
,van Bel
F
,Kavelaars
A
и др.Долгосрочная нейропротекция с помощью 2-иминобиотина, ингибитора нейрональной и индуцибельной синтазы оксида азота, после церебральной гипоксии-ишемии у новорожденных крыс
.J Cereb Blood Flow Metab
2005
;25
:67
–74
141Dingman
A
,Lee
SY
,Derugin
N
и др.Аминогуанидин ингибирует активацию каспазы-3 и кальпаина, не влияя на активацию микроглии после неонатальной транзиторной церебральной ишемии
.J Neurochem
2006
;96
:1467
–79
142Кряква
C
,Vexler
ZS.
Моделирование ишемии в незрелом мозге: насколько трансляционными являются модели на животных?
Ход
2015
;46
:3006
–11
143Juul
SE
,Ferriero
DM.
Фармакологические стратегии нейрозащиты при неонатальном повреждении головного мозга
.Клин Перинатол
2014
;41
:119
–31
144Вентилятор
X
,Heijnen
CJ
,van der
KOOIJMA
и др.Благоприятное влияние эритропоэтина на сенсомоторную функцию и белое вещество после гипоксии-ишемии у новорожденных мышей
.Pediatr Res
2011
;69
:56
–61
145Juul
SE
,Mayock
DE
,Comstock
BA
и др.Нейропротекторный потенциал эритропоэтина у новорожденных; дизайн рандомизированного исследования
.Matern Health Neonatol Perinatol
2015
;1
:27
146Рангараджан
V
,Juul
SE.
Эритропоэтин: новая роль эритропоэтина в нейропротекции новорожденных
.Pediatr Neurol
2014
;51
:481
–8
147Мессье
AM
,Ohls
RK.
Нейропротекторное действие средств, стимулирующих эритропоэз, у доношенных и недоношенных новорожденных
.Curr Opin Pediatr
2014
;26
:139
–45
148Lan
K-M
,Tien
L-T
,Cai
Z
и др.Эритропоэтин улучшает вызванные гипоксией-ишемией неонатальные нейроповеденческие дефициты, нейровоспаление и повреждение гиппокампа у молодых крыс
.Int J Mol Sci
2016
;17
:289
149van der Kooij
MA
,Groenendaal
F
,Kavelaars
A
и др.Нейропротекторные свойства и механизмы эритропоэтина в экспериментальных моделях гипоксии / ишемии in vitro и in vivo
.Brain Res Rev
2008
;59
:22
–33
150Эльмахди
H
,Эль-Машад
A-R
,Эль-Бахрави
H
и др.Человеческий рекомбинантный эритропоэтин при асфиксии новорожденных: пилотное исследование
.Педиатрия
2010
;125
:e1135
–42
151Benders
MJ
,van der Aa
NE
,Roks
M
и др.Возможность и безопасность эритропоэтина для нейропротекции после перинатального артериального ишемического инсульта
.J Педиатр
2014
;164
:481
–6
152Reiter
RJ
,Calvo
JR
,Karbownik
M
и др.Мелатонин и его связь с иммунной системой и воспалением
.Ann N Y Acad Sci
2000
;917
:376
–86
153Villapol
S
,Fau
S
,Renolleau
S
и др.Мелатонин способствует миелинизации, уменьшая воспаление белого вещества после инсульта новорожденного
.Pediatr Res
2011
;69
:51
–5
154Робертсон
Нью-Джерси
,Фолкнер
S
,Fleiss
B
и др.Мелатонин усиливает гипотермическую нейрозащиту в модели перинатальной асфиксии
.Brain J Neurol
2013
;136
:90
–105
155Jantzie
LL
,Todd
кг.
Доксициклин подавляет провоспалительные цитокины, но не ингибирует острый церебральный цитогенез после гипоксии-ишемии у новорожденных крыс
.J Psychiatry Neurosci JPN
2010
;35
:20
–32
156Billings
RJ
,Berkowitz
RJ
,Watson
г.
Зубья
.Педиатрия
2004
;113
:1120
–7
157Самолет
JM
,Shen
Y
,Pleasure
DE
и др.Перспективы нейропротекции миноциклина
.Arch Neurol
2010
;67
:1442
–8
158Tsuji
M
,Wilson
MA
,Lange
MS
и др.Миноциклин ухудшает гипоксически-ишемическое повреждение головного мозга у новорожденных мышей модели
.Exp Neurol
2004
;189
:58
–65
159Sriram
K
,Miller
DB
,O’Callaghan
JP.
Миноциклин ослабляет активацию микроглии, но не снижает дофаминергическую нейротоксичность полосатого тела: роль альфа-фактора некроза опухоли
.J Neurochem
2006
;96
:706
–18
160Klein
NC
,Cunha
BA.
Тетрациклины
.Med Clin North Am
1995
;79
:789
–801
161Кастильо
A
,Толон
MR
,Фернандес-Руис
J
и др.Нейропротекторный эффект каннабидиола в модели in vitro гипоксически-ишемического повреждения головного мозга у мышей опосредуется CB (2) и аденозиновыми рецепторами
.Neurobiol Dis
2010
;37
:434
–40
162Lafuente
H
,Alvarez
FJ
,Pazos
MR
и др.Каннабидиол уменьшает повреждение головного мозга и улучшает функциональное восстановление после острой гипоксии-ишемии у новорожденных свиней
.Pediatr Res
2011
;70
:272
–7
163Lafuente
H
,Pazos
MR
,Alvarez
A
и др.Влияние каннабидиола и гипотермии на кратковременное повреждение головного мозга у новорожденных поросят после острой гипоксии-ишемии
.Front Neurosci
2016
;10
:323
164Pazos
MR
,Cinquina
V
,Gómez
A
и др.Введение каннабидиола новорожденным крысам после гипоксии-ишемии уменьшает длительное повреждение головного мозга и восстанавливает нейроповеденческую функцию
.Нейрофармакология
2012
;63
:776
–83
165Пазос
MR
,Мохаммед
N
,Lafuente
H
и др.Механизмы нейропротекции каннабидиола у новорожденных свиней с гипоксически-ишемией: роль рецепторов 5HT (1A) и CB2
.Нейрофармакология
2013
;71
:282
–91
166Stempak
D
,Gammon
J
,Klein
J
и др.Фармакокинетика однократной и стационарной дозы целекоксиба у детей
.Clin Pharmacol Ther
2002
;72
:490
–7
167Клык
L
,Gao
H
,Zhang
W
и др.Ресвератрол облегчает повреждение нервов после церебральной ишемии и реперфузии у мышей, подавляя воспаление и апоптоз
.Int J Clin Exp Med
2015
;8
:3219
–26
168Feng
Y
,Cui
Y
,Gao
J-L
и др.Ресвератрол ослабляет аутофагию нейронов и воспалительное повреждение путем ингибирования сигнального пути TLR4 / NF-κB при экспериментальной черепно-мозговой травме
.Int J Mol Med
2016
;37
:921
–30
169Поддон
S
,Li
S
,Hu
Y
и др.Ресвератрол после лечения защищает от травм головного мозга новорожденных после гипоксии-ишемии
.Oncotarget
2016
;7
:79247
–61
170West
T
,Atzeva
M
,Holtzman
DM.
Полифенолы граната и ресвератрол защищают мозг новорожденного от гипоксически-ишемического повреждения
.Dev Neurosci
2007
;29
:363
–72
171Левин
S.
Аноксико-ишемическая энцефалопатия у крыс
.Am J Pathol
1960
;36
:1
–17
172Chung
YL
,Lee
MY
,Wang
AJ
и др.В терапевтической стратегии используются ингибиторы гистондеацетилазы для модуляции экспрессии генов, участвующих в патогенезе ревматоидного артрита
.Mol Ther
2003
;8
:707
–17
173Kim
HJ
,Rowe
M
,Ren
M
и др.Ингибиторы гистондеацетилазы проявляют противовоспалительное и нейропротекторное действие на модели перманентного ишемического инсульта у крыс: множественные механизмы действия
.J Pharmacol Exp Ther
2007
;321
:892
–901
174Рен
M
,Ленг
Y
,Jeong
M
и др.Вальпроевая кислота снижает повреждение головного мозга, вызванное временной очаговой церебральной ишемией у крыс: потенциальная роль в ингибировании гистондеацетилазы и индукции белка теплового шока
.J Neurochem
2004
;89
:1358
–67
175Лю
XS
,Чопп
M
,Кассис
H
и др.Вальпроевая кислота увеличивает восстановление белого вещества и нейрогенез после инсульта
.Neuroscience
2012
;220
:313
–21
Заметки автора
Раскрытие информации о финансировании: Эта работа была поддержана Национальным научным центром, грантом Польши 2015/17 / N / NZ7 / 00969 и Уставным фондом Медицинского исследовательского центра Мосаковского номер 17/2017.
Конфликт интересов: Авторы не заявляют о двойственности или конфликте интересов.
© Американская ассоциация невропатологов, 2017 г. Все права защищены.
Гипоксико-ишемическая энцефалопатия (ГИЭ) | UF Health, Университет Флориды, Здоровье
Определение
Гипоксия означает снижение поступления кислорода к органам, включая мозг. Ишемия относится к недостаточному кровоснабжению органов. Энцефалопатия – это термин, используемый для описания любой формы генерализованной дисфункции головного мозга. Гипоксически-ишемическая энцефалопатия (или ГИЭ) – это неспецифический термин для обозначения дисфункции головного мозга, вызванной недостатком притока крови и кислорода к мозгу.Иногда ГИЭ также называют асфиксией при рождении, но этот термин относится только к очень строгим критериям младенцев с черепно-мозговой травмой.
Альтернативные имена
HIE
Причины, частота возникновения и факторы риска
Как и когда возникает ГИЭ?
Существует множество проблем во время беременности, родов, родов и после родов, которые могут вызвать ГИЭ. Однако во многих случаях причина ГИЭ неизвестна.
Возможные проблемы при беременности
Преэклампсия, сахарный диабет матери с сосудистыми заболеваниями, врожденные инфекции плода, злоупотребление наркотиками и алкоголем, тяжелая анемия плода, сердечные заболевания, пороки развития легких, проблемы с кровотоком к плаценте.
Проблемы при родах
Несчастные случаи с пуповиной, разрыв плаценты или матки, чрезмерное кровотечение из плаценты, неправильное положение плода, длительные поздние стадии родов, очень низкое кровяное давление у матери (вызванное лекарствами, кровотечением, анестезией).
Проблемы после доставки
Тяжелая недоношенность, тяжелое заболевание легких или сердца, серьезные инфекции (особенно менингит или сепсис), травма мозга или черепа, врожденные пороки развития мозга, очень низкое кровяное давление у ребенка.
Насколько распространен ГИЭ?
Что касается доношенных детей, ГИЭ встречается примерно у 3-20 случаев на 1000 живорождений. У недоношенных новорожденных ГИЭ встречается у 60% живорождений.
Типы
- Легкая ГИЭ : Менее 5% этих младенцев будут иметь тяжелую инвалидность.
- Умеренная ГИЭ: От 25% до 75% этих младенцев будут иметь тяжелую инвалидность или потенциально умереть в раннем возрасте.
- Тяжелая ГИЭ: 75% или более этих младенцев будут иметь тяжелую инвалидность или потенциально умрут в раннем возрасте.
Признаки и симптомы
до рождения
- Измерения движений плода и / или вариабельности сердечного ритма до рождения.
- Наличие мекония (первый стул ребенка) в околоплодных водах. Это плохой предиктор повышенного риска ГИЭ, но может указывать на то, что плод находился в тяжелом состоянии до рождения.
Клиническая оценка
Анализы, процедуры
Лабораторная оценка
Анализы крови позволяют оценить наличие других повреждений органов, вызванных ГИЭ.Это связано с тем, что снижение кровотока и кислорода может повлиять на все органы, а не только на мозг. Почки, печень, сердце и легкие являются наиболее частыми органами, пораженными ГИЭ. Образцы пуповинной крови могут показать повышенное накопление кислоты. Это может быть признаком того, что младенец до рождения находился в тяжелом состоянии.
Радиологическая оценка
Визуализация головного мозга с использованием УЗИ, КТ (компьютерная томография) и МРТ (магнитно-резонансная томография) могут использоваться для оценки основной деформации головного мозга и поиска доказательств травмы головного мозга.В настоящее время МРТ является наиболее чувствительным способом поиска травм головного мозга, но младенец может быть слишком болен, чтобы его можно было транспортировать для МРТ, или он / она может не переносить долгое время сканирования (примерно 45 минут).
Как лечится ГИЭ?
К сожалению, окончательного лечения младенцев с ГИЭ не существует. Большинство методов лечения направлены на поддержку пораженных органов младенца, в том числе:
- Поддержка сердца и артериального давления
- Поддержание функции почек и печени
- Может потребоваться искусственная вентиляция легких, если младенец не может полностью дышать самостоятельно
- Если у ребенка судороги, его необходимо контролировать с помощью лекарств
В настоящее время единственной терапией, специфичной для мозга, которая, как было доказано, снижает риск долгосрочных нарушений развития нервной системы, является гипотермия мозга или всего тела (охлаждение тела ребенка до примерно 33 ° С.5 градусов по Цельсию или 92 градуса по Фаренгейту) в течение 3 дней. См. Гипотермия.
Группы поддержки
Ожидания (прогноз)
Младенцы с ограниченными возможностями с ГИЭ, проявляющиеся по мере роста, различаются в зависимости от степени тяжести ГИЭ. В то время как младенцы с легкой степенью ГИЭ практически не имеют долгосрочной инвалидности, младенцы, перенесшие ГИЭ от средней до тяжелой степени, могут умереть в период новорожденности или иметь медицинские состояния, включая церебральный паралич, умственную отсталость, трудности с кормлением, нарушения обучаемости, нарушения зрения или слуха и т. Д. судороги.
Прогноз, основанный на клинической классификации, следующий:
- ГИЭ легкой степени: Менее 5% этих младенцев будут иметь тяжелую инвалидность.
- Умеренная ГИЭ: От 25% до 75% этих младенцев будут иметь тяжелую инвалидность или потенциально умереть в раннем возрасте.
- Тяжелая ГИЭ: 75% или более этих младенцев будут иметь тяжелую инвалидность или потенциально умрут в раннем возрасте.
Углекислый газ и мозговое кровообращение | Анестезиология
Деннис М.Фишер, доктор медицины, редактор
Артериальное парциальное давление углекислого газа (Па CO ( 2 )) является важным регулятором мозгового кровообращения, и эта связь описывается в большом количестве литературы. Этот обзор суммирует текущее состояние знаний о влиянии CO 2 на физиологию мозга, уделяя внимание сначала механизмам изменения сосудистого тонуса, вызванного CO 2 , а затем эффекту CO 2 на регуляцию сосудов головного мозга. и, наконец, о манипуляциях CO 2 при уходе за пациентами.
Изменения pH могут оказывать влияние на тонус гладких мышц через системы вторичных мессенджеров и непосредственно изменяя концентрацию кальция в гладких мышцах сосудов. В этом разделе рассматривается роль простаноидов, NO, циклических нуклеотидов, калиевых каналов и внутриклеточной концентрации кальция в изменениях тонуса сосудов головного мозга, опосредованных CO 2 .
Простаноиды.Производство простагландинов контролируется доступностью арахидоновой кислоты, которая отщепляется от липидов мембран фосфолипазой. Циклооксигеназа превращает арахидоновую кислоту в простагландин h3, который впоследствии модифицируется другими ферментами с образованием как сосудосуживающих, так и сосудорасширяющих простаноидов. Основными вазоактивными простаноидами в головном мозге являются простагландин E 2 (PGE 2 ) и простациклин (PGI 2 ), простаноиды-расширители и простаноиды-констрикторы F 2 альфа (PGF 2 альфа).[15] Некоторые исследования показали, что у взрослых людей и животных индометацин, ингибитор циклооксигеназы, снижает вызванную гиперкапнией церебральную вазодилатацию. [16–19] Однако в других исследованиях сообщалось, что индометацин не снижает церебральную вазодилатацию, вызванную гиперкапнией. [20–23] Хотя индометацин снижает вызванное гиперкапнией увеличение CBF у людей, аспирин и напроксен не действуют, даже если имеется равная степень ингибирования циклооксигеназы. [16] Другие сообщили у животных и людей, что ингибиторы циклооксигеназы аспирин, сулиндак, амфенак и дикольфенак не изменяют реакцию мозгового кровообращения на гиперкапнию.[19,20,24,25] У взрослых людей и животных концентрации арахидоновой кислоты в мозге, PGI 2 и PGE 2 не повышаются во время гиперкапнии. [16,26–28] В целом, данные у взрослых показывают, что продукты циклооксигеназы не ответственны за расширение сосудов головного мозга во время гиперкапнии. Влияние индометацина на церебральную вазодилатацию, вызванную гиперкапнией, трудно разрешить. Однако индометацин ингибирует другие ферменты, кроме циклооксигеназы, включая фосфодиэстеразу, фосфолипазу A 2 и циклическую аденозинмонофосфат (цАМФ) -зависимую протеинкиназу, что указывает на неселективность действия индометацина.[26]
Церебральное кровообращение новорожденных и взрослых реагирует на CO ( 2 ) аналогичным образом, хотя степень ответа может быть меньше у новорожденных (см. Ниже). У новорожденных простаноиды важны для регуляции мозгового кровообращения. [29] У новорожденных животных повреждение in vivo эндотелия церебральных сосудов предотвращает опосредованное гиперкапнией повышение концентрации PGI 2 в спинномозговой жидкости и расширение церебральных кровеносных сосудов.[8] Ингибирование фосфолипазы, которая предотвращает высвобождение арахидоновой кислоты и продукцию простаноидов, устраняет реакцию кровообращения новорожденных на гиперкапнию и внеклеточный ацидоз. [30] Кроме того, индометацин ингибирует вызванную гиперкапнией церебральную вазодилатацию и увеличивает концентрации PGI 2 и PGE 2 в CSF у новорожденных животных. [31,32] У новорожденных людей индометацин устраняет вызванное гиперкапникой увеличение CBF. [33] Эти данные подтверждают идею о том, что у новорожденных простагландины, расширяющие сосуды, происходящие из эндотелия сосудов, играют важную роль в ответе на гиперкапнию.Однако альтернативная роль простагландинов была предложена некоторыми исследователями, которые сообщают у новорожденных животных, что после ингибирования циклооксигеназы или повреждения эндотелия нанесение на мозг очень низкой концентрации простаноидов-вазодилататоров восстанавливает вызванную гиперкапнией церебральную вазодилатацию. [7,34] Эти данные предполагают, что простаноиды могут не быть прямыми медиаторами церебральной вазодилатации, вызванной гиперкапнией, а скорее, что базальный уровень простаноидов необходим, чтобы «позволить» гиперкапнии расширять церебральные кровеносные сосуды.В целом, данные показывают, что продукты циклооксигеназы являются важными регуляторами гиперкапнической реакции новорожденного, но не мозгового кровообращения у взрослых.
Оксид азота. Оксид азота является важным регулятором тонуса сосудов головного мозга и вырабатывается семейством NO-синтазных ферментов в эндотелиальных клетках сосудов головного мозга, некоторых периваскулярных нервах, паренхиматозных нейронах и глии. [35,36] Оксид азота активирует гуанилатциклазу в гладких мышцах сосудов, увеличивая внутриклеточную концентрацию циклического гуанозинмонофосфата (цГМФ), вызывая вазорелаксацию.[36] У взрослых животных ингибирование активности NO-синтазы снижает церебральную вазодилатацию во время гиперкапнии [37–41] и церебральную вазодилатацию, опосредованную внеклеточным ацидозом. [39] Это указывает на то, что NO является одним из сосудорасширяющих средств, важных для реакции мозгового кровообращения на гиперкапнию и ацидоз. Хотя эти исследования показывают, что NO играет важную роль в индуцированной CO 2 церебральной вазодилатации, они также предполагают, что NO не является единственным сосудорасширяющим сигналом, потому что после ингибирования NO-синтазы остается 10–70% опосредованной гиперкапнией церебральной вазодилатации.Широкий диапазон снижения церебральной вазодилатации может отражать использование различных ингибиторов NO-синтазы, доз ингибиторов, времени введения доз, степени гиперкапнии и видовых различий. Во время тяжелой гиперкапнии (Pa CO 2 > 100 мм рт. Ст.) Опосредованное CO 2 расширение церебральных артериол не может быть уменьшено путем ингибирования NO-синтазы, что указывает на то, что церебральная вазодилатация во время тяжелой гиперкапнии не зависит от NO. [37] В отличие от взрослых, NO не играет роли в вызванной гиперкапнией церебральной вазодилатации у новорожденных животных.[32]
Хотя из этих исследований можно предположить, что гиперкапния увеличивает синтез NO, что приводит к расширению сосудов головного мозга, некоторые исследования предлагают альтернативное объяснение. Мозг тонически вырабатывает NO, создавая постоянный сосудорасширяющий сигнал. [36] Ингибирование NO-синтазы удаляет тонический NO и увеличивает тонус покоя в церебральных кровеносных сосудах, что может изменить ответ на другие вазоактивные сигналы, такие как гиперкапния.Таким образом, ингибирование NO-синтазы может вызывать прямой эффект, предотвращая опосредованную гиперкапнией активацию NO-синтазы, и косвенные эффекты, снижая базальные уровни NO и цГМФ и повышая тонус кровеносных сосудов в состоянии покоя. После ингибирования NO-синтазы низкие концентрации NO-зависимых и NO-независимых вазодилататоров могут восстановить тонус сосудов головного мозга до исходного уровня. [9] Однако NO-зависимые, но не NO-независимые вазодилататоры могут восстанавливать ответ на гиперкапнию. [9] Кроме того, проницаемый для клеток аналог цГМФ может также восстанавливать базальный сосудистый тонус и реакцию на гиперкапнию после ингибирования NO-синтазы.[9] Эти данные предполагают, что изменения базального тонуса не важны, поскольку NO-независимые вазодилататоры не могут восстановить ответ на гиперкапнию. Эти данные показывают, что NO и цГМФ играют важную роль в расширении сосудов головного мозга, опосредованном CO 2 . Однако NO и цГМФ могут быть не конечными медиаторами вазодилатации, а скорее тем, что базальные уровни NO и цГМФ «позволяют» гиперкапнии расширять сосуды головного мозга. Оксид азота может также выполнять «разрешающую» роль для других сосудорасширяющих средств в мозговом кровообращении.[42,43]
В головном мозге сосудистый эндотелий экспрессирует эндотелиальную изоформу NO-синтазы, а некоторые периваскулярные нервы, паренхиматозные нейроны и глия экспрессируют нейрональную изоформу NO-синтазы. [36,44–46] Все они являются потенциальными источниками NO, важного для вызванной гиперкапнией церебральной вазодилатации. [36] Повреждение эндотелия сосудов in vivo не снижает вызванную гиперкапнией вазодилатацию [6], что указывает на то, что эндотелиальная изоформа NO-синтазы не является источником NO, участвующего в вызванной гиперкапнией церебральной вазодилатации.Селективное ингибирование нейрональной изоформы NO-синтазы снижает вызванную гиперкапнией церебральную вазодилатацию, что указывает на важность активности нейрональной NO-синтазы. [47] Церебральные периваскулярные нервы, исходящие из клиновидно-небных ганглиев, выделяют NO, но, по-видимому, не играют важной роли при гиперкапнии, потому что разрушение этих нервов не влияет на реакцию сосудов головного мозга на гиперкапнию. [48] Кроме того, тетродотоксин, который блокирует натриевые каналы и предотвращает деполяризацию нейронов, не снижает церебральную вазодилатацию, вызванную гиперкапнией.[9] Это указывает на то, что активация нейрональной NO-синтазы деполяризацией периваскулярных нервов или паренхиматозных нейронов не важна для индуцированной гиперкапнией церебральной вазодилатации. NO, ответственный за индуцированную гиперкапнией церебральную вазодилатацию, может возникать либо из паренхиматозных нейронов, продуцирующих NO в отсутствие деполяризации, либо из глии. Однако избирательное разрушение корковых нейронов не влияет на вызванную гиперкапнией церебральную вазодилатацию, что указывает на то, что паренхиматозные нейроны не участвуют в ответе на гиперкапнию.[10] Таким образом, данные свидетельствуют о том, что у взрослых животных эндотелий сосудов, паренхиматозные нейроны и периваскулярные нервы не являются источником NO, важного для опосредованной гиперкапнией вазодилатации. Нейрональная NO-синтаза, по-видимому, является источником NO, участвующего в вызванной гиперкапнией церебральной вазодилатации, но клеточная локализация неизвестна. Источником NO может быть глия, которая экспрессирует нейрональную NO-синтазу, но также возможно, что несколько перекрывающихся источников NO могут участвовать в индуцированной гиперкапнией церебральной вазодилатации.
В отличие от гиперкапнии, изменения тонуса сосудов головного мозга при гипокапнии не зависят от NO. У взрослых кроликов и крыс сужение сосудов головного мозга во время гипокапнии не изменяется из-за ингибирования NO-синтазы. [38,49]
Циклических нуклеотидов. Изменения концентраций циклических нуклеотидов важны в сигнальном каскаде, ведущем от pH к изменениям тонуса гладких мышц сосудов.Оксид азота активирует гуанилатциклазу в гладких мышцах сосудов, увеличивая концентрацию цГМФ, в то время как простаноиды, расширяющие сосуды (PGE 2 , PGI 2 ), активируют аденилатциклазу и увеличивают концентрацию цАМФ. [32,36] У взрослых крыс гиперкапния увеличивает концентрацию цГМФ в головном мозге, что согласуется с теорией, согласно которой гиперкапния увеличивает выработку NO, которая затем увеличивает цГМФ. [40] Однако в изолированных церебральных артериях взрослых крыс увеличение P CO 2 расслабляет артерии, но не увеличивает цГМФ, что согласуется с «разрешающей» гипотезой, согласно которой увеличение NO и цГМФ не требуется для CO 2. -опосредованное расширение сосудов головного мозга.[1] Циклический GMP важен при гиперкапнии; однако, как и после ингибирования NO-синтазы, инфузия низкой концентрации стабильного аналога цГМФ восстанавливает вызванную гиперкапнией вазодилатацию в головном мозге. [9] Как и в случае с NO, у взрослых животных неясно, действует ли цГМФ как вазодилататорный медиатор во время гиперкапнии или необходимы ли базальные уровни цГМФ для «разрешения» индуцированной гиперкапнией церебральной вазодилатации.
У новорожденных свиней гиперкапния вызывает расширение сосудов головного мозга и повышение концентрации PGI2 и цАМФ в головном мозге; ингибирование циклооксигеназы предотвращает эти изменения.[32] Эти данные предполагают, что цАМФ опосредует вазодилатацию во время гиперкапнии у новорожденных. Хотя сосудорасширяющие простаноиды могут действовать разрешительно при гиперкапнии у новорожденных, неизвестно, может ли цАМФ играть аналогичную разрешающую роль.
Калиевые каналы. Последние данные свидетельствуют о том, что калиевые каналы гладких мышц сосудов играют важную роль в регулировании сосудистого тонуса головного мозга. [50] В гладких мышцах сосудов открытие калиевых каналов позволяет калию (главному внутриклеточному катиону) диффундировать из клетки, делая внутреннюю часть клетки более негативной (гиперполяризованной).Когда клетка гиперполяризована, потенциалзависимые кальциевые каналы уменьшают приток внеклеточного кальция, уменьшая внутриклеточную концентрацию кальция и снижая тонус гладких мышц сосудов.
Одна подгруппа калиевых каналов чувствительна к АТФ (K ATP ). Снижение pH увеличивает вероятность открытого состояния каналов K ATP (которые будут гиперполяризовать клетки), подтверждая концепцию, что во время гиперкапнии активация каналов K ATP может вызвать гиперполяризацию гладких мышц сосудов и вазодилатацию головного мозга.[51] Кроме того, внеклеточный ацидоз гиперполяризует гладкие мышцы сосудов головного мозга, что также подтверждает концепцию, что изменения потенциала гладкомышечных мембран сосудов важны во время гиперкапнии. [2] В крупных мозговых артериях in vitro ослабление ацидоза частично зависит от активации каналов K ATP . [52] У взрослых животных церебральная вазодилатация при умеренном (Pa CO 2 [почти =] 55 мм рт.[41,53]
Второй калиевый канал – это активированный кальцием калиевый канал с большой проводимостью. Этот канал может активироваться цГМФ и NO, гиперполяризуя гладкие мышцы сосудов и снижая внутриклеточный кальций. [54,55] Он способствует цГМФ-зависимой вазодилатации в малых церебральных артериолах [56], но не в крупных церебральных артериях. [57] В отличие от каналов K АТФ , активированные кальцием калиевые каналы с большой проводимостью не вносят вклад в вызванную ацидозом вазодилатацию в изолированных крупных церебральных артериях.[52] Отсутствие важности этих каналов во время вызванной ацидозом вазодилатации в крупных церебральных артериях может отражать региональную гетерогенность распределения калиевых каналов.
Третий калиевый канал – это калиевый канал выпрямителя с задержкой (K V ). Этот канал обычно активируется деполяризацией мембраны, что приводит к реполяризации за счет выхода калия из клетки. [50] В гладких мышцах сосудов головного мозга каналы K V чувствительны к pH, а ацидоз увеличивает проводимость K V , гиперполяризуя клетку.[58] Это говорит о том, что каналы K V должны активироваться во время гиперкапнии и способствовать расширению. Однако в изолированных крупных церебральных артериях блокада каналов K V не изменяет дилатацию на ацидоз. [52] Как и в случае калиевых каналов с большой проводимостью, это несоответствие может отражать региональные различия в распределении калиевых каналов в мозговом кровообращении.
Внутриклеточный кальций.Тонус гладких мышц сосудов контролируется концентрацией внутриклеточного кальция. В исходных условиях внутриклеточный кальций составляет приблизительно 0,1 микрометра, что в 10 000 раз меньше, чем внеклеточный кальций. Небольшие изменения в кальциевой проводимости плазматической мембраны могут иметь значительное влияние как на внутриклеточную концентрацию кальция, так и на тонус гладких мышц сосудов. Во время алкалоза в гладких мышцах сосудов головного мозга увеличивается внутриклеточная концентрация кальция, что повышает тонус. [59] В гладких мышцах сосудов головного мозга изменения внеклеточного pH влияют на концентрацию внутриклеточного кальция и тонус сосудов.[60] Расширение церебральных артериол, вызванное внеклеточным ацидозом, можно предотвратить повышением внеклеточного кальция, что предполагает, что снижение поступления кальция в гладкие мышцы сосудов важно для снижения тонуса сосудов из-за ацидоза. [5] Циклические нуклеотиды (цАМФ и цГМФ) частично влияют на тонус сосудов, изменяя концентрацию кальция в гладких мышцах. [54,61] И цАМФ, и цГМФ, по-видимому, активируют свои соответствующие протеинкиназы и фосфорилируют кальциевые каналы, что снижает поступление кальция в гладкие мышцы сосудов.[61,62] Циклические нуклеотиды также активируют калиевые каналы, что приводит к гиперполяризации мембран и инактивации потенциалзависимых кальциевых каналов, снижая внутриклеточную концентрацию кальция. [61]
Ингаляционные анестетики. У бодрствующих людей гипервентиляция снизила CBF на 0,9 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 [центральная точка] мм рт. Ст. CO 2 -1 , а также во время анестезии 1% галотаном (и закись азота) гипервентиляция снизила CBF на 2 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 [центральная точка] мм рт. ст. CO ( 2 ) -1 .[81] Хотя гипервентиляция вызывала большее снижение CBF во время анестезии галотаном, потому что галотан увеличивал нормокапническую CBF с 53 до 88 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 , абсолютная CBF была выше во время гипервентиляция галотаном по сравнению с гипервентиляцией в состоянии бодрствования. [81] У людей под наркозом галотаном с нормокапническим CBF 50 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 CBF снижалась на 1,4 мл на каждый 1 мм рт. 2 .[63] У животных под наркозом галотаном гипервентиляция всегда снижает CBF, и наклон этого снижения напрямую связан с нормокапническим CBF. [68,73,86,102–104] Эти данные указывают на то, что мозговое кровообращение реагирует на гипервентиляцию во время анестезии галотаном, и реакция усиливается при увеличении нормокапнического кровотока.
У людей снижение CBF за счет гипервентиляции было больше во время анестезии изофлураном, чем в состоянии бодрствования.[105] Важность нормокапнического CBF в определении ответа на гипервентиляцию во время изофлурановой анестезии была продемонстрирована у собак, где нормокапнический CBF при 2,8% изофлуране примерно вдвое больше, чем при использовании 1,4% изофлурана, а снижение CBF при гипокапнии при 2,8% изофлуране составляет также примерно вдвое больше, чем у 1,4% изофлурана. [106] У людей и животных, анестезированных изофлураном, CBF всегда снижается гипервентиляцией, и степень снижения напрямую связана с нормокапническим CBF.[68,80,82,102,104,107,108] У людей и собак, анестезированных десфлураном или севофлураном, гипокапния снижает CBF, и степень снижения также связана с нормокапническим CBF. [109–112]
У людей, подвергшихся воздействию 70% закиси азота (N 2 O), нормокапническая CBF составляет 40–45 мл [центральная точка] 100 г – 1 [центральная точка] мин ( – 1 ), и гипокапния снижает CBF примерно на 1 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 [центральная точка] мм рт. ст. CO 2 -1 .[69,72] Вызванное гипокапнией снижение CBF не нарушается у коз, подвергшихся воздействию 50% N 2 O. [78] У людей добавление N 2 O к пропофоловой анестетике не изменяет кровоток в средней мозговой артерии. скорость или реакция мозгового кровообращения на гипокапнию. [113] Однако добавление N 2 O к галотановому анестетику у кроликов увеличивало нормокапнический CBF и наклон ответа на гипокапнию. [104]
Несколько исследований подтверждают концепцию, согласно которой, увеличивая нормокапнический мозговой кровоток, ингаляционные анестетики усиливают реакцию мозгового кровообращения на гипокапнию.[68,102,105,106] Хотя наклон ответа на гипокапнию может быть увеличен с помощью ингаляционных анестетиков, это не означает, что CBF можно снизить до более низких абсолютных значений во время ингаляционной анестезии (т. Е. Вызывает большее сужение сосудов). Повышенный нормокапнический CBF во время ингаляционных анестетиков приводит к более высоким абсолютным значениям CBF во время гипокапнии, несмотря на повышенный относительный ответ на гипокапнию. Во время ингаляционной анестезии, когда нормокапнический CBF сопоставим с состоянием бодрствования, снижение CBF за счет гипокапнии аналогично таковому в состоянии бодрствования.
Внутривенные анестетики. Во время тиопентальной анестезии у людей гипокапния снижает CBF, но по мере увеличения глубины анестезии и снижения нормокапнического CBF ответ CBF на снижение Pa CO 2 также уменьшается. [69,114] Аналогичные результаты были получены для тиопентала у бабуинов и собак. [115,116] Во время анестезии пропофолом у людей мозговое кровообращение реагирует на гипокапнию и гиперкапнию.[66] Однако, по сравнению с состоянием бодрствования у людей, анестезия пропофолом снижает скорость кровотока в средней мозговой артерии и гипокапническое снижение скорости кровотока. [113] Кроме того, гипокапния мозгового кровообращения меньше во время глубоких уровней анестезии пропофолом. [117] Во время анестезии этимидатом у людей CBF линейно связан с Pa CO 2 . [118] Во время седации мидазоламом у людей гиперкапния увеличивает CBF. [119] После индукции анестезии фентанилом и диазепамом у людей CBF линейно связан с Pa CO 2 .[120] У животных, анестезированных морфином или фентанилом с N 2 O, гипокапния снижает CBF. [68,79] Хотя данные по внутривенным анестетикам менее изучены, чем ингаляционные анестетики, они показывают, что при снижении нормокапнического CBF также снижается ответ CBF на гипокапнию.
У людей, когда Pa CO 2 снижается до 20-25 мм рт. Ст., CBF снижается до 20-25 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 .[63,69,70,72] Однако CBF остается> 20 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 даже во время крайней гипокапнии под наркозом (Pa CO 2 = 10 мм рт. Ст.) [72] и люди без анестезии (Па CO 2 = 16 мм рт. Ст.). [86] У животных снижение Pa CO 2 <20 мм рт. Ст. Не приводит к дальнейшему снижению CBF. [71,121,138] У нормотермных людей и приматов без анестезии самые ранние признаки и симптомы церебральной ишемии, такие как спутанность сознания, неспособность выполнять команды, очаговые неврологические дефициты и замедление электрической активности мозга, измеренные с помощью электроэнцефалограммы (ЭЭГ) , происходят при глобальных уровнях CBF 20–30 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 .[146,147] Однако CBF должен быть уменьшен до <10 мл [центральная точка] 100 г -1 [центральная точка] мин -1 , чтобы вызвать острую гибель нейронов. [147] Гипервентиляция может снизить CBF до уровня, связанного с легкой церебральной ишемией, а у людей и животных снижение Pa CO 2 до 20-25 мм рт.ст. замедляет ЭЭГ [148,149] и ухудшает умственную функцию [150,151] что предполагает возникновение легкой ишемии головного мозга. Помимо снижения CBF, выраженный алкалоз сдвигает кривую диссоциации оксигемоглобина влево, дополнительно ограничивая доставку кислорода в мозг.Таким образом, многие исследователи предполагают, что вызванные гипокапнией изменения ЭЭГ и умственной деятельности являются следствием церебральной ишемии.
Предварительное исследование на людях показало, что вызванное гипервентиляцией замедление ЭЭГ может быть отменено гипербарическим кислородом, что предполагает, что гипервентиляция снижает доставку кислорода и ограничивает церебральный метаболизм. [149] Концентрация лактата в головном мозге увеличивается во время тяжелой гипокапнии и обратно пропорциональна Pa CO 2 , что указывает на недостаток кислорода для поддержания окислительного метаболизма.[87,152–154] Кортикальное давление кислорода снижается во время гипокапнии, а тяжелая гипокапния (10 мм рт. [155 156]
Хотя гипервентиляция замедляет ЭЭГ, вызванные гипервентиляцией изменения в ЭЭГ могут не отражать церебральную ишемию. У человека гипокапния и гипоксия вызывают различные изменения спектральных диапазонов мощности ЭЭГ.[157] Кроме того, поскольку гипербарический кислород может увеличивать частоту ЭЭГ и вызывать судороги, неясно, представляет ли обращение вызванных гипервентиляцией изменений ЭЭГ специфический или неспецифический эффект. [158] Производство лактата в головном мозге зависит от pH, и по мере увеличения pH производство лактата увеличивается независимо от наличия кислорода. [153 159]
У животных и людей гипокапния до Pa CO 2 10–20 мм рт. Ст. Не изменяет скорость метаболизма кислорода в мозге, что позволяет предположить, что мозг получает достаточно кислорода для поддержания окислительного метаболизма.[65,86,160,161] В большинстве [152–154], но не во всех, [162–164] исследованиях сообщается, что уровни в мозге высокоэнергетических соединений, таких как аденозинтрифосфат (АТФ) и фосфокреатин, не изменяются во время тяжелой гипокапнии, что позволяет предположить, что достаточно кислород достигает мозга, чтобы поддерживать окислительное фосфорилирование. У новорожденных животных церебральный метаболизм не нарушается во время тяжелой гипокапнии (Pa CO 2 <20 мм рт. Ст.) [161], а запасы энергии в головном мозге не снижаются. [126]
В целом, эти исследования показывают, что в нормальном мозге гипокапния может снизить CBF до порога церебральной ишемии, но не до CBF, связанного с быстрой гибелью нейронов.Если гипокапния вызывает церебральную ишемию в нормальном мозге, она должна быть легкой и не связана с грубыми нарушениями окислительного метаболизма мозга. Однако долгосрочное влияние гипервентиляции на нормальный мозг неизвестно, потому что нет данных относительно вызванной гипервентиляцией потери нейронов или постоянных функциональных изменений.
Патофизиология и терапия церебральной ишемии сложны и плохо изучены, и полный обзор церебральной ишемии выходит за рамки этого обзора.В попытке увеличить приток крови к ишемическому мозгу, Pa CO 2 манипулировали во время церебральной ишемии. Однако манипуляции с Pa CO 2 влияют не только на CBF, но и на pH мозга, что может влиять на ишемию головного мозга независимо от CBF. [165] Кроме того, небольшие колебания температуры мозга могут существенно повлиять на тяжесть церебрального ишемического инсульта, и во многих исследованиях температура мозга не контролировалась должным образом. [166] Трудно ретроспективно оценить взаимодействие этих факторов во время исследований манипуляций Pa CO 2 и церебральной ишемии.Однако в этом разделе основное внимание будет уделено влиянию манипуляции Pa CO 2 на CBF во время церебральной ишемии, а также тому, как такие изменения CBF могут повлиять на церебральную ишемию и уход за пациентами.
Фокальная ишемия головного мозга. Церебральная эмболизация или окклюзия сосудов головного мозга приводит к очаговой ишемии головного мозга. Предполагается, что гипервентиляция полезна во время очаговой ишемии головного мозга, сужая неишемический мозг и направляя кровоток в ишемический мозг (известный как Робин Гуд или обратное обкрадывание).Эта гипотеза предполагает, что в ишемическом мозге отсутствует вазоконстрикция, вызванная гипокапникой. Раннее исследование на собаках показало, что гипервентиляция уменьшала объем инфаркта головного мозга после окклюзии средней мозговой артерии, что предполагает благоприятное перераспределение кровотока за счет гипервентиляции. [167] Однако те же исследователи [168] и другие [169] позже сообщили на кошках и приматах, что гипервентиляция не уменьшает объем инфаркта мозга после окклюзии средней мозговой артерии.У кошек с окклюзией средней мозговой артерии гипервентиляция не увеличивает приток крови к ишемизированному мозгу. [77,170] Кроме того, во время очаговой церебральной ишемии у приматов гипервентиляция усугубляла снижение высокоэнергетических соединений мозга и нарушала окислительный метаболизм в ишемизированном мозге, что позволяет предположить, что гипервентиляция усугубляет церебральную ишемию. [171, 172] У крыс с окклюзией средней мозговой артерии гипервентиляция увеличивает площадь ишемизированного мозга. [107] У людей, перенесших инсульт, CBF в ишемизированном головном мозге низкий и может быть дополнительно снижен за счет гипервентиляции.[173,174] Однако приток крови к ишемическому мозгу увеличивается примерно у 10% пациентов, перенесших инсульт. [174] Гипервентиляция у людей с острым очаговым инсультом не влияет на исход болезни. [175]
Временная фокальная церебральная ишемия может быть вызвана у людей во время пережатия сонной артерии при эндартерэктомии. Гипокапния во время пережатия сонной артерии не снижает частоту новых неврологических нарушений после каротидной эндартерэктомии, что позволяет предположить, что CBF неблагоприятно перераспределяется гипокапнией.[176] Когда CBF измеряли во время пережатия сонной артерии у людей, гипокапния уменьшала CBF в ишемическом полушарии головного мозга у трех из семи пациентов, но увеличивала CBF у одного из семи пациентов. [177] Отчет также указывает, что гипокапния сочеталась с артериальная гипертензия была эффективна в обращении ишемических изменений на ЭЭГ во время пережатия сонной артерии. [178]
Таким образом, хотя раннее исследование на животных показало, что гипервентиляция была полезной при очаговой церебральной ишемии, другие экспериментальные исследования показали, что гипервентиляция не приносит пользы и может быть вредна из-за дальнейшего снижения CBF в ишемизированном мозге.У людей с очаговой церебральной ишемией гипервентиляция, по-видимому, вызывает благоприятное перераспределение CBF (обратного обкрадывания) примерно у 10% пациентов. Оценка того, полезна или вредна гипервентиляция у отдельных пациентов с очаговой церебральной ишемией, требует измерения CBF, церебральной функции или того и другого. Кроме того, из-за кратковременного воздействия изменений Pa CO 2 на CBF, любое усиление CBF, вероятно, будет временным.
Было высказано предположение, что гиперкапния полезна при очаговой ишемии за счет расширения сосудов ишемизированного мозга и увеличения кровотока.Гиперкапния также может снизить приток крови к ишемическому мозгу за счет вазолидации нормального мозга и отклонения кровотока от ишемизированного мозга, который не может быть дополнительно расширен гиперкапнией (внутримозговое обкрадывание). У животных с окклюзией средней мозговой артерии гиперкапния не изменяет или не снижает кровоток в ишемизированном мозге. [77,170,179,180] У животных с очаговой ишемией гиперкапния не расширяет артерии в ишемизированной коре головного мозга. [77,181] У людей, перенесших острый инсульт, гиперкапния не увеличивает кровоток в ишемизированном мозге.[182,183] Через несколько дней после начала фокального инсульта у людей реакция CBF на гиперкапнию более неоднородна: у некоторых пациентов наблюдается повышенный, а у других сниженный кровоток в ишемизированном мозге. [184] Однако у собак с очаговой церебральной ишемией умеренная гиперкапния увеличивала кровоток в ишемизированном мозге и улучшала соматосенсорные вызванные потенциалы. [185] Положительный результат исследований гиперкапнии и гипокапнии у собак может отражать различия в коллатеральном мозговом кровообращении у собак, что предрасполагает этих животных к пользе от изменений Pa CO ( 2 ).Однако в целом данные показывают, что гиперкапния не способствует лечению очаговой церебральной ишемии.
Глобальная ишемия. Глобальная ишемия головного мозга возникает при остановке сердца; после реанимации может возникнуть церебральная гиперфузия или гипоперфузия. В попытке усилить CBF в состоянии после ареста было изменено Pa CO 2 . Однако после глобальной церебральной ишемии у животных реакция мозгового кровообращения на гипокапнию ослабляется или исчезает [130, 186, 187], а реакция на гиперкапнию заметно ослабляется.[130,187,188] У новорожденных поросят CBF может быть снижен гипокапнией, но гиперкапния не увеличивает CBF после глобальной ишемии. [130,189] Однако после глобальной ишемии у молодых свиней реактивность мозгового кровообращения CO 2 является нормальной через 2 часа после ишемии. [130] У кроликов, подвергшихся глобальной церебральной ишемии, гипокапния снижает высвобождение глутамата и глицина во время ишемии, что предполагает менее серьезное повреждение нейронов. [190] После глобальной церебральной ишемии у собак гиперкапния, но не гипокапния, задерживала электрофизиологическое восстановление [191], что позволяет предположить, что гиперкапния была пагубной.Также у собак гипервентиляция улучшила гистопатологию головного мозга через 15 минут после остановки сердца. [192,193] Таким образом, хотя некоторые данные предполагают, что гипокапния может быть полезной после глобальной ишемии, невозможно сделать окончательный вывод относительно потенциальных преимуществ. Более того, большинство исследований показывают, что реакция мозгового кровообращения на CO 2 заметно ослабляется или исчезает сразу после глобальной церебральной ишемии. Подобные данные, касающиеся манипуляции с Pa CO 2 после остановки сердца у людей, недоступны.
Гипервентиляция – распространенный компонент лечения повышенного ВЧД. Большинство данных о гипервентиляции при лечении повышенного ВЧД получено из исследований пациентов с травмами головы. В конце 1960-х – начале 1970-х годов была предложена гипервентиляция для снижения уровня смертности пациентов после травм головы. [194–196] Однако эти отчеты трудно интерпретировать, потому что часто не измерялось Pa CO 2 .Что еще более важно, контрольные пациенты в этих исследованиях дышали спонтанно естественными дыхательными путями. Таким образом, невозможно оценить степень достигнутой гипервентиляции и вклад поддержания дыхательных путей и возможного улучшения оксигенации на результаты этих исследований.
В конце 1970-х и 1980-х годах несколько авторов сообщили, что уровень смертности от травм головы снижался, если использовался мультимодальный подход к лечению, включающий гипервентиляцию.[197,198] Однако другие исследователи [199] сообщили, что ИВЛ не влияла на исход у пациентов с травмой головы. В 1991 году рандомизированное проспективное исследование пациентов с травмой головы показало, что гипервентиляция изначально ухудшала исход у части пациентов, но через 1 год после травмы не было разницы между пациентами с гипервентиляцией и без гипервентиляции. [200] Из-за присущих этому исследованию проблем, включая гипервентиляцию у пациентов с нормальным ВЧД и относительно небольшие различия в Pa CO ( 2 ) между гипокапнической и нормокапнической группами, трудно сделать выводы о влиянии гипервентиляции. об исходе у пациентов с травмами головы.[200]
После травмы головы концентрация лактата в спинномозговой жидкости увеличивается [201], и гипервентиляция считается полезной для коррекции ацидоза мозга. [202] Однако у кошек с тяжелым поражением головного мозга, вызванным жидкостной перкуссией, внутриклеточный рН мозга снижается лишь временно после травмы [203], а гипервентиляция увеличивает выработку лактата мозгом. [204] Таким образом, внутриклеточный ацидоз головного мозга после травмы кажется ограниченным, а гипервентиляция может усугубить ацидоз за счет увеличения выработки лактата.
Церебральный кровоток может быть низким и нормальным ВЧД после травмы головы, особенно в первые часы после травмы. [205] Некоторые авторы предположили, что снижение CBF после травмы головы представляет собой церебральную ишемию. [205] Однако церебральный метаболизм также снижается после травмы головы, и снижение CBF может не отражать церебральную ишемию, а скорее может отражать соответствующую взаимосвязь между потоком и метаболизмом. [206] Поскольку мозговое кровообращение обычно сохраняет некоторую чувствительность к CO 2 после травмы головы, гипервентиляция может еще больше снизить CBF.[173,206–208] Однако одного снижения CBF недостаточно для возникновения церебральной ишемии, поскольку порог ишемии зависит не только от кровотока, но и от метаболизма. У некоторых пациентов с черепно-мозговой травмой гипервентиляция снижает CBF, увеличивает артериовенозную экстракцию кислорода и снижает скорость метаболизма кислорода в головном мозге, что свидетельствует о начале церебральной ишемии. [206] У животных с ВЧД, повышенным до порога церебральной ишемии, гипервентиляция снижает уровень фосфокреатина в мозге, что предполагает церебральную ишемию.[209] Таким образом, данные о мозговом метаболизме свидетельствуют о том, что после травмы головы гипервентиляция может снизить CBF до уровня церебральной ишемии.
Острая гипервентиляция эффективна для контроля повышенного ВЧД [210, 211], и в отличие от только что отмеченных исследований, гипервентиляция может увеличить CBF за счет снижения ВЧД. [212] Однако, поскольку гипервентиляция имеет временные эффекты на CBF и CBV, это только временная мера для контроля повышенного ВЧД.[205] Текущие рекомендации по лечению Pa CO 2 после травмы головного мозга не рекомендуют использовать профилактическую гипервентиляцию и предполагают, что гипервентиляцию следует использовать только тогда, когда повышенное ВЧД невосприимчиво к другим методам контроля. [205]
Недавние сообщения предполагают, что измерение объективного параметра церебральной оксигенации или CBF может оценить влияние гипервентиляции на метаболическое состояние мозга у пациентов с травмами головы.[213,214] Возможность оптимизировать перфузию головного мозга позволит более рационально лечить отдельных пациентов. Однако предлагаемые методы не были оценены проспективно, и их влияние на исход болезни неизвестно.
Основываясь на клиническом опыте и экспериментальных данных, повышенное ВЧД можно снизить за счет острой гипервентиляции. По мере снижения ВЧД повышается церебральное перфузионное давление и может увеличиваться CBF.Однако после травмы головы, несмотря на наличие комы, у некоторых пациентов могло наблюдаться снижение CBF и нормальное ВЧД. Когда ВЧД в норме, гипервентиляция не приносит пользы и может быть вредна за счет дальнейшего снижения CBF. Следует избегать профилактического или неизбирательного использования гипервентиляции у пациентов с травмами головы, а гипервентиляцию следует использовать для лечения острого повышения ВЧД. Поскольку влияние гипервентиляции на CBF, CBV и ICP является временным, необходимы другие вмешательства для долгосрочного контроля ICP.
Гипервентиляция считается неотъемлемым компонентом анестезиологического обеспечения пациентов, перенесших внутричерепные операции. Предполагается, что гипокапния приносит пользу за счет снижения CBV и ICP, что позволяет втягивать ткань мозга с меньшей силой, тем самым улучшая операционное воздействие. Гипервентиляция была предложена в качестве дополнения к анестезиологическому лечению при внутричерепных операциях в конце 1950-х годов.До этого большинство пациентов, перенесших внутричерепные операции, дышали спонтанно во время наркоза. Хотя было признано, что гиперкапния увеличивает CBV и ICP, [216] в ранних обсуждениях анестезиологического обеспечения пациентов, перенесших нейрохирургические операции, не упоминается контролируемая вентиляция легких или гипервентиляция. [217,218] В 1957 году субъективный отчет подробно описал использование интраоперационной гипервентиляции для улучшения внутричерепных операционных условий. [219] Позже, когда ВЧД и Pa CO 2 были измерены у наркозных пациентов, перенесших внутричерепную операцию, Pa CO 2 и ВЧД часто были повышены (Pa CO 2 > 60 мм рт. гипервентиляция »восстановила только Pa CO 2 до нормального уровня.[220] Последующие отчеты поддержали использование интраоперационной гипервентиляции, но эти отчеты являются субъективными, а не критическими оценками техники. [221, 222] Во всех этих отчетах спонтанная вентиляция сравнивается с гипервентиляцией, причем гипервентиляция обычно определяется на основе минутной вентиляции, а не измерения Pa CO 2 .
В начале 1960-х годов сообщалось, что гипервентиляция у пациентов, перенесших трепанацию черепа, снижает натяжение твердой мозговой оболочки, что было оценено хирургами без ослепления.[223,224] Однако Pa CO 2 не измеряли, анестетики не стандартизировали, а гипервентиляцию сравнивали со спонтанной вентиляцией. [223,224] Эти исследователи также сообщили, что у пациентов со спонтанным дыханием осмотические дегидратирующие агенты были так же эффективны, как гипервентиляция, в снижении дурального давления. [224] Хотя в этих анекдотических сообщениях не указывается, приводит ли гипервентиляция к гипокапнии или нормокапнии, они положили начало традиции гипервентиляции у пациентов, перенесших внутричерепные операции.
К середине 1960-х исследователи сообщили, что галотан может увеличивать CBF и ICP. [225, 226] Гипервентиляция перед введением галотана была предложена как метод ослабления индуцированного галотаном повышения ВЧД. [227,228] Позже сообщалось, что изофлуран увеличивает CBF и ICP, [229,230] и снова была предложена гипервентиляция в качестве метода компенсации увеличения ICP, вызванного изофлураном. [229] В отличие от галотана, изофлуран-опосредованное повышение ВЧД можно было предотвратить, если одновременно с введением изофлурана вводили гипервентиляцию.[229, 231] У собак 2% изофлуран значительно увеличивал CBV, а гипервентиляция ослабляла этот эффект. [99] Однако у собак с супратенториальными объемными образованиями введение изофлурана после индукции гипервентиляции не приводит к дальнейшему увеличению ВЧД. [232]
У людей, перенесших трепанацию черепа, степень гипервентиляции, необходимая для предотвращения увеличения ВЧД, вызванного ингаляционными анестетиками, по-видимому, варьируется, что отражает индивидуальную изменчивость внутренних механизмов компенсации увеличения CBV.В одном исследовании пациентов с внутричерепными опухолями ВЧД не отличался (12–15 мм рт. Ст.) При умеренной гипокапнии (Pa CO 2 [почти =] 30 мм рт. Ст.) Во время анестезии либо изофлураном с закисью азота, либо пропофолом с фентанилом. [233] Однако другие исследователи сообщали о пациентах с внутричерепными опухолями, что изофлуран увеличивал ВЧД с 14 до 22 мм рт. Ст., Несмотря на гипервентиляцию, до уровня CO 2 в конце выдоха, равного 26 мм рт. [234] У пациентов, перенесших процедуры шунтирования спинномозговой жидкости, изофлуран повысил ВЧД с 4 до 26 мм рт. Ст., А последующая гипервентиляция снизила ВЧД до 2 мм рт.[231] Хотя гипервентиляция обычно используется у пациентов, перенесших внутричерепную операцию, влияние гипервентиляции на исход болезни не оценивалось объективно. Кроме того, относительная степень необходимой гипервентиляции также не была определена. Гипервентиляция может снизить повышенное ВЧД и компенсировать влияние ингаляционных анестетиков на ВЧД. Однако из-за изменчивого характера внутричерепного заболевания степень гипервентиляции, требуемая у отдельных пациентов, может быть оценена только на индивидуальной основе.Необходимость и степень гипервентиляции у пациентов должны определяться предоперационными признаками и симптомами повышенного ВЧД, исследованием внутричерепного содержимого во время трепанации черепа и измерением ВЧД.
За последние 100 лет многое было изучено относительно CO 2 и мозгового кровообращения. Сегодня много известно о механизмах изменения тонуса сосудов головного мозга, опосредованных CO 2 .Ключевым этапом передачи сигналов, опосредованной CO 2 , является изменение внеклеточного pH мозга. После изменения pH изменения внутриклеточной концентрации кальция являются конечным общим медиатором как при гиперкапнии, так и при гипокапнии. У взрослых животных NO и цГМФ способствуют умеренному, но не заметному расширению сосудов головного мозга, вызванному гиперкапнией. Однако NO и цГМФ не могут быть прямыми вазодилататорами, а могут выполнять «разрешающую» роль. У новорожденных продукты циклооксигеназы и цАМФ важны для вызванной гиперкапнией церебральной вазодилатации, но они также могут не быть прямыми вазодилататорами.Наконец, активация каналов K АТФ важна для расширения церебральных сосудов до умеренной гиперкапнии у взрослых.
Между Па CO 2 значений от 20 до 80 мм рт.ст. CBF изменяется с 1 на 2 мл [центральная точка] 100 г -1 [центральная точка] мин. -1 на каждое изменение Па CO на 1 мм рт. 2 . Изменение CBF связано с нормокапническим CBF, и при увеличении кровотока возрастает относительный ответ на гипокапнию.Во время устойчивых изменений Pa CO 2 CBF возвращается к исходному уровню в течение нескольких часов из-за коррекции внеклеточного pH мозга. Анестетики, которые увеличивают CBF, усиливают снижение CBF за счет гипокапнии, а анестетики, которые снижают CBF, уменьшают ответ. Объем церебральной крови изменяется аналогично CBF, но относительное изменение менее выражено. Гипотония ниже нижнего предела ауторегуляции ослабляет или отменяет реакцию мозгового кровообращения на изменения Pa CO 2 .Гиперкапния может ослабить или отменить ауторегуляцию. Ответ CBF на изменения Pa CO 2 увеличивается в процессе развития от новорожденного до взрослого. Однако во время старения реакция на гипокапнию не меняется, пока нормокапнический CBF не изменяется. Нелеченная гипертензия не влияет на реакцию мозгового кровообращения на изменения Pa CO 2 . Гипотермия снижает нормокапнический CBF и ответ CBF на изменения Pa CO 2 .Многие исследования пытались продемонстрировать вызванную гипокапнином ишемию в нормальном мозге, но четких доказательств этому нет.
Во время временной очаговой ишемии головного мозга ни гиперкапния, ни гипокапния не улучшаются и фактически не могут ухудшить исход. Сообщалось, что гипокапния увеличивает приток крови к ишемическому мозгу во время временной и постоянной очаговой церебральной ишемии у меньшинства пациентов. Данные на животных показывают, что гипервентиляция может улучшить некоторые показатели церебрального благополучия после глобальной церебральной ишемии.Однако данных для оценки эффекта гипервентиляции после глобальной ишемии у человека нет. Когда ВЧД повышается, острая гипервентиляция может снизить ВЧД и может увеличить CBF. Однако влияние гипервентиляции на исход пациента остается неопределенным. Текущие рекомендации – оставить гипервентиляцию для лечения повышенного ВЧД, которое невозможно контролировать другими методами. После субарахноидального кровообращения мозговое кровообращение реагирует на снижение Pa CO 2 , хотя реакция может быть ослаблена при наличии вазоспазма.Интраоперационная гипервентиляция, по-видимому, полезна для контроля ВЧД, компенсации эффекта ингаляционных анестетиков и улучшения внутричерепных операционных условий. Однако объективные данные об интраоперационной гипервентиляции и оперативном воздействии или исходах патента отсутствуют. При клиническом уходе за пациентами в операционной необходимость и степень гипервентиляции могут определяться только путем оценки признаков и симптомов повышенного ВЧД, осмотра внутричерепного содержимого во время трепанации черепа и измерения ВЧД.Как и в отделении интенсивной терапии, было бы разумно избегать ненужной гипервентиляции в операционной.
Автор благодарит докторов наук. Брэдли Дж. Хиндман, Фрэнк М. Фарачи и Константино Ядекола за полезные предложения.
Оценка по шкале Апгар | ACOG
Номер 644 (Заменяет заключение Комитета № 333, май 2006 г. Подтверждено в 2021 г.)
Комитет по акушерской практике
Американская академия педиатрии – Комитет по плодам и новорожденным
Этот документ отражает новые клинические и научные авансы на дату выдачи и могут быть изменены.Информация не должна толковаться как предписывающая исключительный курс лечения или процедуры, которым необходимо следовать. Этот документ отражает новые концепции безопасности пациентов и может быть изменен. Информация не должна толковаться как предписывающая исключительный курс лечения или процедуры, которым необходимо следовать.
РЕЗЮМЕ: Оценка по шкале Апгар представляет собой общепринятый и удобный метод сообщения о состоянии новорожденного сразу после рождения и реакции на реанимацию, если это необходимо.Сама по себе оценка по шкале Апгар не может рассматриваться как свидетельство или следствие асфиксии, не позволяет прогнозировать индивидуальную неонатальную смертность или неврологический исход и не должна использоваться для этой цели. Оценка по шкале Апгар, присвоенная во время реанимации, не эквивалентна оценке, присвоенной ребенку со спонтанным дыханием. Американская академия педиатрии и Американский колледж акушеров и гинекологов поощряют использование расширенной формы отчетности по шкале Апгар, которая учитывает одновременные реанимационные вмешательства.
Введение
В 1952 году доктор Вирджиния Апгар разработала систему баллов, которая представляла собой быстрый метод оценки клинического состояния новорожденного в возрасте 1 минуты и необходимости немедленного вмешательства для установления дыхания 1. Второй отчет с оценкой в 1958 г. было опубликовано большее количество пациентов. 2. Эта система баллов обеспечивала стандартизированную оценку младенцев после родов. Оценка по шкале Апгар состоит из пяти компонентов: 1) цвет, 2) частота сердечных сокращений, 3) рефлексы, 4) мышечный тонус и 5) дыхание, каждому из которых присваивается оценка 0, 1 или 2.Таким образом, оценка по шкале Апгар позволяет количественно оценить клинические признаки неонатальной депрессии, такие как цианоз или бледность, брадикардия, подавленный рефлекторный ответ на стимуляцию, гипотонию и апноэ или затрудненное дыхание. Оценка сообщается через 1 минуту и 5 минут после рождения для всех младенцев, а затем через 5-минутные интервалы до 20 минут для младенцев с оценкой менее 7 3. Оценка по шкале Апгар представляет собой принятый и удобный метод для сообщения о статусе новорожденный сразу после рождения и реакция на реанимацию, если это необходимо; однако его неправильно использовали для прогнозирования индивидуального неблагоприятного неврологического исхода.Цель этого утверждения – представить оценку по шкале Апгар в ее правильном ракурсе. Это заявление пересматривает Заключение комитета колледжа 2006 года и Заявление о политике AAP, чтобы включить обновленное руководство из Neonatal Encephalopathy and Neurologic Outcome , Second Edition, а также новое руководство по неонатальной реанимации.
В рекомендациях программы реанимации новорожденных указано, что оценка по шкале Апгар
полезна для передачи информации об общем состоянии новорожденного и реакции на реанимацию.Однако реанимация должна быть начата до того, как будет выставлена 1-минутная оценка. Таким образом, оценка по шкале Апгар не используется для определения потребности в первоначальной реанимации, необходимых шагов по реанимации или когда их использовать 3.
Оценка по шкале Апгар, которая остается 0 после достижения возраста 10 минут, может, тем не менее, быть полезной при определении показаны ли дальнейшие реанимационные мероприятия, потому что очень немногие младенцы с оценкой по шкале Апгар 0 через 10 минут выжили с нормальным неврологическим исходом 3 4 5.В соответствии с этим, в рекомендациях Программы реанимации новорожденных 2011 г. говорится, что «если вы можете подтвердить, что частота сердечных сокращений не определялась в течение как минимум 10 минут, прекращение реанимационных мероприятий может быть целесообразным» 3.
Неонатальная энцефалопатия и неврологический исход , Второе издание, опубликованное в 2014 году Колледжем в сотрудничестве с AAP, определяет 5-минутный балл по шкале Апгар 7–10 как обнадеживающий, балл 4–6 как умеренно ненормальный, а балл 0–3 – как низкий балл. Доношенный и поздно недоношенный ребенок 6.В этом документе оценка по шкале Апгар 0–3 через 5 минут или более рассматривается как неспецифический признак заболевания, который «может быть одним из первых признаков энцефалопатии» 6. Однако постоянно низкий балл по шкале Апгар сам по себе не является конкретным показателем для компромисс во время родов. Кроме того, хотя шкала широко используется в исследованиях исходов, ее неправильное использование привело к ошибочному определению асфиксии. Асфиксия определяется как выраженное нарушение газообмена, ведущее, если оно длительное, к прогрессирующей гипоксемии, гиперкапнии и значительному метаболическому ацидозу.Термин асфиксия, который описывает процесс разной степени тяжести и продолжительности, а не конечную точку, не следует применять к событиям родов, если только конкретные доказательства значительного нарушения газообмена во время родов или в ближайшем послеродовом периоде не могут быть задокументированы на основании лабораторных исследований 6.
Ограничения оценки по шкале Апгар
Важно понимать ограничения оценки по шкале Апгар. Оценка по шкале Апгар – это выражение физиологического состояния младенца в определенный момент времени, которое включает субъективные компоненты.Существует множество факторов, которые могут влиять на оценку по шкале Апгар, в том числе седативный эффект или анестезия матери, врожденные пороки развития, гестационный возраст, травмы и вариабельность между наблюдателями 6. Кроме того, биохимические нарушения должны быть значительными, чтобы повлиять на оценку. Элементы оценки, такие как тон, цвет и рефлекторная раздражительность, могут быть субъективными и частично зависеть от физиологической зрелости младенца. На счет также могут влиять вариации нормального перехода. Например, более низкое начальное насыщение кислородом в первые несколько минут не требует немедленного введения дополнительного кислорода; целевые показатели насыщения кислородом в программе реанимации новорожденных составляют 60–65% через 1 минуту и 80–85% через 5 минут 3.Здоровый недоношенный ребенок без признаков асфиксии может получить низкий балл только из-за незрелости 7 8. Частота низких баллов по шкале Апгар обратно пропорциональна массе тела при рождении, а низкий балл не может предсказать заболеваемость или смертность для любого отдельного ребенка 8 9. Как указывалось ранее, также нецелесообразно использовать только шкалу Апгар для диагностики асфиксии.
Оценка по шкале Апгар и реанимация
Оценка по шкале Апгар за 5 минут и, в частности, изменение оценки между 1 и 5 минутами, является полезным показателем реакции на реанимацию.Если оценка по шкале Апгар меньше 7 через 5 минут, в рекомендациях Программы реанимации новорожденных указано, что оценку следует повторять каждые 5 минут в течение до 20 минут. 3. Однако оценка по шкале Апгар, присвоенная во время реанимации, не эквивалентна присвоенной оценке. ребенку со спонтанным дыханием 10. Не существует общепринятого стандарта для регистрации баллов по шкале Апгар у младенцев, подвергающихся реанимации после рождения, потому что многие элементы, влияющие на оценку, изменяются в результате реанимации.Была предложена концепция вспомогательной оценки, учитывающей реанимационные вмешательства, но ее предсказательная надежность не изучалась. Чтобы правильно описать таких младенцев и обеспечить точную документацию и сбор данных, рекомендуется использовать расширенную форму отчета по шкале Апгар. Рисунок 1. Эта расширенная оценка по шкале Апгар также может оказаться полезной при отсроченном пережатии пуповины, когда время рождения ( полные роды), время пережатия пуповины и время начала реанимации можно записать в поле для комментариев.
Сама по себе оценка по шкале Апгар не может рассматриваться как свидетельство или следствие асфиксии. Многие другие факторы, включая неутешительные паттерны мониторинга сердечного ритма плода и аномалии газов пуповинной артериальной крови, клиническую церебральную функцию, нейровизуализационные исследования, неонатальную электроэнцефалографию, патологию плаценты, гематологические исследования и дисфункцию мультисистемных органов, необходимо учитывать при диагностике гипоксически-ишемии во время родов. Событие 5. Когда отслеживание ЧСС плода Категории I (нормальное) или Категории II (неопределенное) связано с оценкой по шкале Апгар 7 или выше через 5 минут, нормальным pH артериальной крови пуповины (± 1 стандартное отклонение) или обоими этими показателями, это не согласуется с острым гипоксически-ишемическим событием 6.
Прогноз исхода
1-минутная оценка по шкале Апгар от 0 до 3 не предсказывает исход какого-либо отдельного ребенка. 5-минутный балл по шкале Апгар от 0 до 3 коррелирует с неонатальной смертностью в больших популяциях 11 12, но не предсказывает индивидуальную будущую неврологическую дисфункцию. Популяционные исследования убедили нас в том, что у большинства младенцев с низким показателем по шкале Апгар церебральный паралич не разовьется. Однако низкий 5-минутный балл по шкале Апгар явно указывает на повышенный относительный риск церебрального паралича, который, как сообщается, в 20–100 раз выше, чем у младенцев с 5-минутным баллом по шкале Апгар 7–10 9 13 14 15.Хотя индивидуальный риск варьируется, популяционный риск неблагоприятных неврологических исходов также увеличивается, когда оценка по шкале Апгар составляет 3 или меньше через 10, 15 и 20 минут 16. Когда новорожденный имеет оценку по шкале Апгар 5 или меньше через 5 минут, пуповина Газ артериальной крови должен быть взят из пережатого участка пуповины, если это возможно. 17. Отправка плаценты на патологическое исследование может быть ценным.
Другие приложения
Может оказаться полезным мониторинг низких баллов по шкале Апгар от службы доставки.Рассмотрение отдельных случаев может выявить потребности в целевых образовательных программах и улучшении систем перинатальной помощи. Анализ тенденций позволяет оценить эффект мероприятий по повышению качества.
Выводы
Оценка по шкале Апгар описывает состояние новорожденного сразу после рождения и при правильном применении является инструментом стандартизированной оценки 18. Она также обеспечивает механизм регистрации перехода от плода к неонатальному. Оценка по шкале Апгар не позволяет прогнозировать индивидуальную смертность или неблагоприятный неврологический исход.Однако, основываясь на популяционных исследованиях, оценка по шкале Апгар менее 5 через 5 минут и 10 минут явно указывает на повышенный относительный риск церебрального паралича, а степень отклонения от нормы коррелирует с риском церебрального паралича. Однако у большинства младенцев с низкими показателями по шкале Апгар церебральный паралич не разовьется. На оценку по шкале Апгар влияет множество факторов, в том числе гестационный возраст, лекарства для беременных, реанимация, а также кардиореспираторные и неврологические состояния. Если оценка по шкале Апгар на 5-й минуте равна 7 или больше, маловероятно, что послеродовая гипоксия – ишемия вызвала неонатальную энцефалопатию.
Рекомендации
Оценка по шкале Апгар не позволяет прогнозировать индивидуальную неонатальную смертность или неврологический исход и не должна использоваться для этой цели.
Неуместно использовать только шкалу Апгар для постановки диагноза асфиксии. Термин асфиксия, который описывает процесс разной степени тяжести и продолжительности, а не конечную точку, не следует применять к событиям родов, если не могут быть задокументированы конкретные доказательства значительного нарушения газообмена во время родов или непосредственно в послеродовом периоде.
Когда новорожденный имеет оценку по шкале Апгар 5 или меньше через 5 минут, следует получить газ крови из пуповинной артерии из пережатого участка пуповины. Отправка плаценты на патологическое исследование может быть ценным.









