Алиментарная дистрофия – серьезное заболевание, возникающее в результате неполноценного питания
Алиментарная дистрофия – болезнь, возникающая в результате длительного неполноценного питания, что приводит к общему истощению организма, нарушению сердечно-сосудистой, психической деятельности, повреждением клеток и межклеточного пространства, тканей и органов с расстройством их функций.
Причины
Причины заболевания – недостаток питательных веществ. Причиной может быть нерациональное питание или голодание, а также недостаточное всасывание питательных веществ. Это может быть обусловлено экзогенными, а также эндогенными нарушениями (сужение пищевода вследствие опухоли или послеоперационного рубца).
Болезнь может развиваться вследствие недостаточного или некалорийного питания, особенно из-за дефицита белков животного происхождения и аминокислот, жирных кислот и витаминов, растворяющих эти жиры.
Если болезнь прогрессирует, начинается гипопротеинемия, наблюдается нарушение работы многих органов, расстройство эндокринной системы.
Симптомы
Степени алиментарной дистрофии:
- У больного усиленный аппетит из-за недостаточности полноценной пищи, его мучает жажда, организм требует большое количество соли. Общее состояние удовлетворительное.
- Больной заметно теряет массу тела, он чувствует постоянную слабость, понижается трудоспособность и температура тела, на ногах возникают отеки гипопротеинемического происхождения, повышается аппетит. Больного мучает жажда, развиваются необратимые изменения во многих органах, возникает нарушение психики.
- На этой стадии развивается кахексия (высшая степень истощения организма), у больного наблюдается полное отсутствие жировой клетчатки под кожей, атрофия мышц, полный упадок сил, апатия, нарушения психики и сердечно-сосудистой системы, печеночная недостаточность, анемия, судороги, мучительные запоры, нередко пролежни.
 Температура тела понижается до тридцати градусов. Возможно развитие голодной комы.
Температура тела понижается до тридцати градусов. Возможно развитие голодной комы.
Диагностика
Диагностика основывается на проявлении вышеназванных симптомов на фоне длительного голодания. Необходимо установить причину истощения организма: вызвано оно голоданием или болезнью.
Лечение
Больному необходимо обеспечить полный физический и психический покой, а также рациональное питание. С каждым днем в рацион больного нужно вводить больше калорий, витаминов и микроэлементов.
Параллельно истощенному организму вводят плазму, белковые гидролизаты, витамины. При нарушениях работы сердечно-сосудистой системы – сердечные препараты, при отеках – мочегонное. Режим необходимо постепенно расширять, показана лечебная физкультура.
Если больной пребывает в голодной коме, ему каждые два часа вводят внутривенно пятидесятипроцентный раствор глюкозы (50 мл). Судороги снимают внутривенным введением хлорида кальция. После выхода из комы больного необходимо напоить сладким горячим чаем и кормить маленькими порциями через каждые два часа.
Если алиментарная дистрофия вызвана опухолью или рубцами, необходимо хирургическое вмешательство для их устранения.
ДИСТРОФИЯ АЛИМЕНТАРНАЯ • Большая российская энциклопедия
В книжной версии
Том 9. Москва, 2007, стр. 81
- Скопировать библиографическую ссылку:
Авторы: И. В. Маев
ДИСТРОФИ́Я АЛИМЕНТА́РНАЯ (трофологическая недостаточность, голодная болезнь, отёчная болезнь, военный отёк), болезнь, обусловленная длительной недостаточностью питания. Характеризуется выраженным общим истощением, дистрофией тканей и органов с нарушением их функций на фоне прогрессирующего нарушения обмена веществ.
Характеризуется выраженным общим истощением, дистрофией тканей и органов с нарушением их функций на фоне прогрессирующего нарушения обмена веществ.
В зависимости от причин Д. а. подразделяют на экзогенную (недостаточное поступление в организм питательных веществ – несоответствие количества и качества принимаемой пищи потребностям организма) и эндогенную (дефицит энергии и белков в связи с механич. препятствием для поступления пищи в желудок – рубцовый или опухолевый стеноз пищевода или привратника,  алкоголизма и связанной с ним патологии внутр. органов (цирроз печени, дистрофия миокарда). Выделяют также Д. а. на фоне недостаточного обеспечения полноценной пищей после отнятия детей от груди.
алкоголизма и связанной с ним патологии внутр. органов (цирроз печени, дистрофия миокарда). Выделяют также Д. а. на фоне недостаточного обеспечения полноценной пищей после отнятия детей от груди.
Клинически Д. а. (т. н. трофологич. недостаточность) обычно проявляется синдромами квашиоркора и маразма. В течении всех форм Д. а. выделяют три стадии. Первая стадия характеризуется снижением питания, учащением мочеиспускания, усилением аппетита, жаждой, избыточным употреблением поваренной соли. Во второй стадии появляются мышечная слабость, расстройства психики, потеря массы тела, отёки ног, трофич. нарушения кожи. Третья стадия, т. н. кахексическая, проявляется отёками, психич. расстройствами, признаками сердечной и печёночной недостаточности, анемией, желудочно-кишечными расстройствами.
Прогноз неблагоприятен при потере массы тела до 40–50%.
Лечение: парентеральное питание, в т. ч. комбинированное с переводом на полноценную диету, богатую витаминами, белком, с дробным (5–7 раз в сутки) приёмом пищи.
Алиментарная дистрофия – причины, симптомы, диагностика и лечение
Общие сведения
Алиментарная дистрофия (алиментарный маразм) – это социальное заболевание, которое может развиться в результате вынужденного или осознанного голодания. На сегодняшний день алиментарным маразмом страдают люди не только в развивающихся странах, во время войн и катастроф – а это более полумиллиона человек. Многие готовы морить себя голодом осознанно в погоне за красивой фигурой и в угоду своим комплексам. Однако заболевание может иметь тяжелые последствия, вплоть до летального исхода. При длительном голодании, отсутствии поступления незаменимых веществ в организме могут произойти необратимые изменения метаболических процессов. В развитых странах все чаще можно услышать о случаях анорексии – а это та же алиментарная дистрофия тяжелой степени.
На сегодняшний день алиментарным маразмом страдают люди не только в развивающихся странах, во время войн и катастроф – а это более полумиллиона человек. Многие готовы морить себя голодом осознанно в погоне за красивой фигурой и в угоду своим комплексам. Однако заболевание может иметь тяжелые последствия, вплоть до летального исхода. При длительном голодании, отсутствии поступления незаменимых веществ в организме могут произойти необратимые изменения метаболических процессов. В развитых странах все чаще можно услышать о случаях анорексии – а это та же алиментарная дистрофия тяжелой степени.
Алиментарная дистрофия
Причины
Причиной алиментарного маразма служит длительное голодание, во время которого в организм поступает недостаточное количество питательных веществ и энергии. При этом учитывается и их относительная недостаточность: когда поступление калорий не соответствует их расходу. Голодание может наступить по разным причинам (война, экологическое бедствие и другие случаи, когда человек вынужденно длительно не получает пищу; диеты; сужение и рубцы пищевода и прочее), однако усугубление процесса провоцируется тяжелым физическим трудом, переохлаждением.
Следует заметить, что развитие дистрофии возможно только при длительном энергетическом голодании. При этом в организме сначала полностью истощаются запасы гликогена и жиров, затем для обеспечения основного обмена используются запасы внутритканевого белка. В первую очередь процессы дистрофии начинаются в коже, мышцах, затем задействуются внутренние органы, в самую последнюю очередь – жизненно важные (сердце, почки и мозг). В какой-то момент процессы катаболизма принимают такую форму, что летальный исход становится неизбежным даже при начале полноценного лечения.
На последних стадиях заболевания в организме истощаются запасы витаминов и минералов, перестает функционировать иммунная система. Летальный исход обычно наступает или от сердечной недостаточности, или от присоединившейся инфекции на фоне значительного угнетения иммунитета.
Классификация
В гастроэнтерологии принято разделять алиментарную дистрофию как по формам, так и по тяжести. По форме заболевание делится на кахектическую (сухую) и отечную. Кахектическая форма имеет более неблагоприятное течение. Отечная форма характеризуется развитием распространенных отеков, в том числе и внутренних (асцит, перикардит и плеврит), эта форма лучше поддается лечению.
По форме заболевание делится на кахектическую (сухую) и отечную. Кахектическая форма имеет более неблагоприятное течение. Отечная форма характеризуется развитием распространенных отеков, в том числе и внутренних (асцит, перикардит и плеврит), эта форма лучше поддается лечению.
По тяжести заболевания различают три стадии. На первой стадии отмечается незначительное снижение массы тела, сохранение работоспособности наряду с появлением жалоб на более частые мочеиспускания, жажду и повышение аппетита, зябкость и слабость. На второй стадии отмечается значительное исхудание с потерей работоспособности. Такие больные еще могут себя обслуживать, но практически не способны на какой-либо труд. Могут появляться отеки, значительно снижается уровень белка, часто бывают эпизоды понижения уровня глюкозы крови. На третьей стадии больные уже не могут самостоятельно передвигаться и вставать с кровати, резко истощены. При появлении голодной комы даже у пациента, который до этого сохранял работоспособность, говорят о третьей стадии заболевания.
Симптомы алиментарной дистрофии
Патология развивается исподволь, нередко пациент может не отдавать себе отчет, что страдает этим недугом. Обычно первые признаки кахексии проявляются только после длительного ограничения поступления в организм не только калорий, но и белка, жиров, незаменимых аминокислот и витаминов (чаще жирорастворимых). Первые симптомы могут быть не замечены или не расценены как опасные: учащение мочеиспускания, полиурия (увеличение суточного объема мочи), слабость и раздражительность, снижение работоспособности, постоянная сонливость. Часто беспокоит жажда, повышенный аппетит. Один из специфических симптомов – склонность к поеданию соли.
Если питание не будет налажено, заболевание прогрессирует и переходит в следующую стадию. При этом кожа становится очень дряблой и сухой, провисает складками, напоминает пергамент. Выполнять любую физическую работу становится очень тяжело, общее состояние страдает достаточно сильно. Появляются первые признаки дистрофии и нарушения функционирования внутренних органов (запоры и другие диспепсические проявления, нарушения работы сердца, эндокринные нарушения – у женщин пропадают менструации, наступает бесплодие). Отмечается склонность к понижению температуры. Сердцебиение урежается, давление низкое. Могут появиться изменения в психике.
Появляются первые признаки дистрофии и нарушения функционирования внутренних органов (запоры и другие диспепсические проявления, нарушения работы сердца, эндокринные нарушения – у женщин пропадают менструации, наступает бесплодие). Отмечается склонность к понижению температуры. Сердцебиение урежается, давление низкое. Могут появиться изменения в психике.
Последняя стадия заболевания характеризуется ярким проявлением угасания всех функция организма. Подкожно-жировой слой отсутствует, мышцы становятся очень тонкими и дряблыми. Самостоятельно передвигаться человек на третьей стадии уже не способен. Отмечается снижение уровня всех клеток крови (эритроцитов, лейкоцитов, тромбоцитов), угнетается иммунитет. В крови отмечается очень низкий уровень белка, склонность к снижению уровня глюкозы. Полностью истощаются запасы витаминов и минералов, кости становятся ломкими. Так как организм запускает катаболизм (разрушение) собственных белков, то в крови начинают накапливаться ядовитые продукты их распада. Это приводит к еще большему ухудшению состояния, появлению выраженных психических расстройств (результат действия продуктов распада на головной мозг). Обычно на последних стадиях заболевания даже начало лечения и питания не может предотвратить печальный исход.
Это приводит к еще большему ухудшению состояния, появлению выраженных психических расстройств (результат действия продуктов распада на головной мозг). Обычно на последних стадиях заболевания даже начало лечения и питания не может предотвратить печальный исход.
Тяжелейшее состояние, которое развивается на последних стадиях алиментарной дистрофии – голодная кома. Возникает она из-за значительного снижения уровня глюкозы в крови и невозможности обеспечить головной мозг необходимым количеством энергии. Клиника этого состояния достаточно яркая: внезапная потеря сознания, бледность и холодность кожи, зрачки широкие. Температура тела значительно понижена. Дыхание поверхностное, может быть редким и неритмичным. Мышцы без тонуса, могут развиться судороги. Пульс практически не определяется, слабый, давление низкое. Если не оказать своевременную помощь, смерть наступит от остановки сердечной деятельности и дыхания.
Также течение алиментарной дистрофии может осложняться присоединением различных инфекций (кишечных, туберкулеза, пневмонии, сепсиса).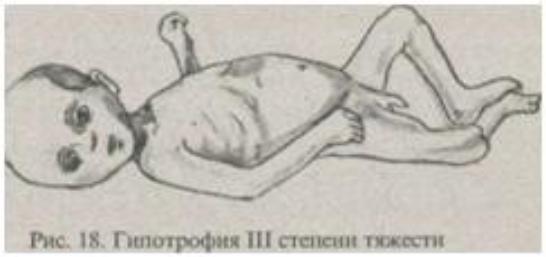 Нередко смерть наступает от эмболии легочной артерии тромбами (ТЭЛА), при перенапряжении во время физических нагрузок.
Нередко смерть наступает от эмболии легочной артерии тромбами (ТЭЛА), при перенапряжении во время физических нагрузок.
Диагностика
Диагноз может быть выставлен на основании тщательного сбора анамнеза и осмотра пациента. Если в анамнезе есть указания на длительное голодание, то имеется характерная для алиментарной дистрофии симптоматика и лабораторные показатели (развернутый клинический и биохимический анализы крови, признаки дистрофии внутренних органов по УЗИ, КТ или МРТ), а также исключили другие заболевания, диагноз не представляет затруднений.
Дифференцировать алиментарную дистрофию следует с другими заболеваниями, которые могут приводить к истощению организма: онкологические процессы (прежде всего рак желудка и кишечника), туберкулез, сахарный диабет, гипофизарные расстройства и тиреотоксикоз. Алиментарную дистрофию от других заболеваний отличает выраженное усиление жажды и аппетита, голод, очень сильное истощение мышц и изменения кожи, брадикардия и снижение температуры тела, нарушение работы всех эндокринных желез.
Лечение алиментарной дистрофии
Лечение данного заболевания на любой стадии начинают с нормализации режима дня, питания, отдыха и сна. Таких больных помещают в теплую проветриваемую палату, не допуская контакта с инфекционными больными. При первой стадии заболевания начинают дробное питание легко усваиваемой пищей. При второй и третьей стадии питание осуществляется как энтерально (энпиты – специальные питательные смеси), так и парентерально путем введения растворов глюкозы и других питательных веществ внутривенно.
Калорийность должна составлять для начала около 3000 ккал/сут, постепенно доводя до 4500 ккал/сут. В рацион обязательно включаются животные белки, общее количество белка должно составлять 2 г/кг/сут. Восполнять необходимо не только питательные вещества, но и жидкость путем инфузии различных растворов. На третьей стадии обязательно проводятся переливания препаратов крови (эритроцитов и плазмы, альбумина). Корректируется кислотно-щелочное состояние организма.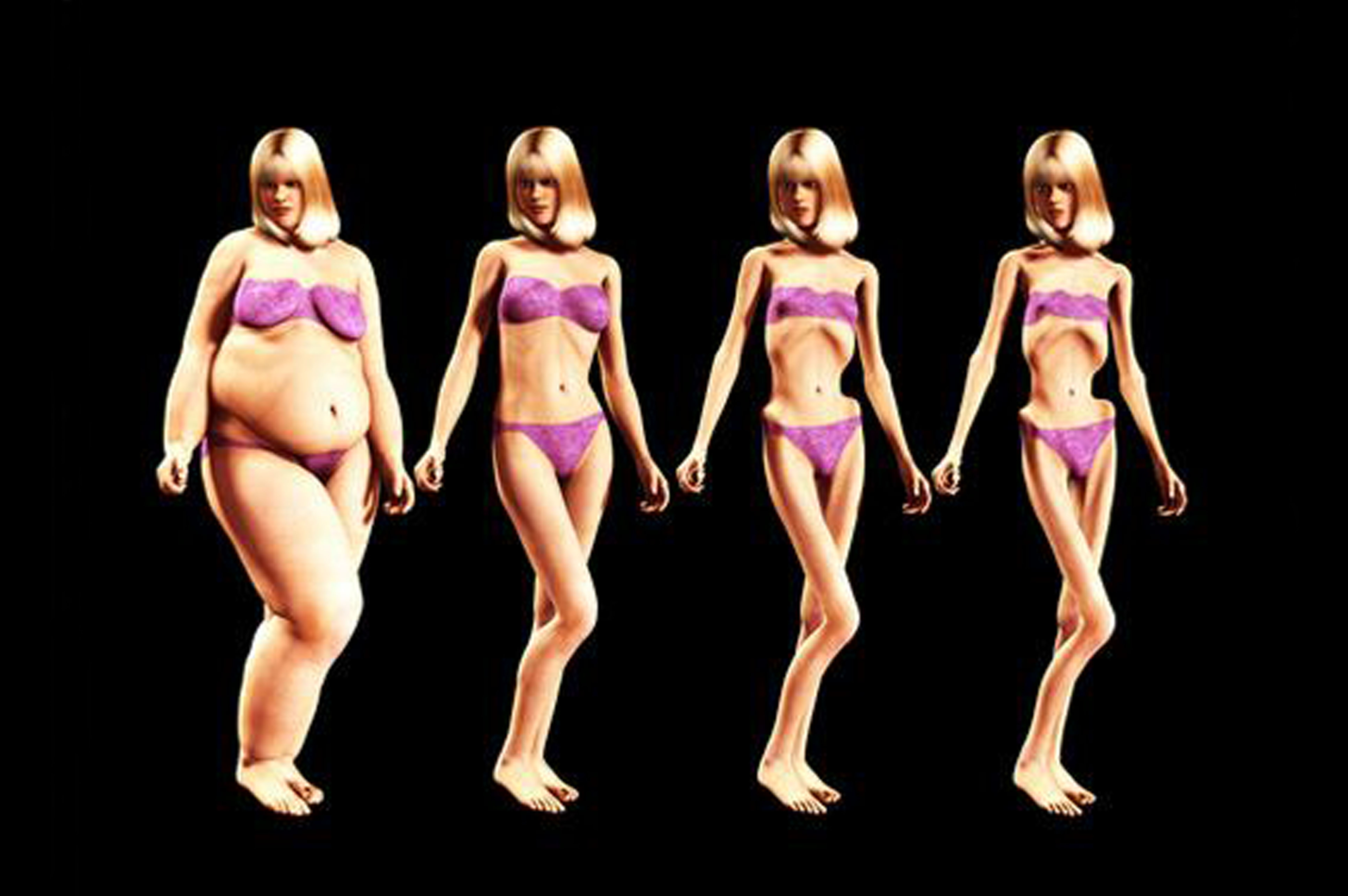
Для лечения инфекционных осложнений вводят антибиотики (согласно чувствительности). Также производится коррекция иммунного статуса, дисбактериоза. Лечение алиментарной комы заключается во введении раствора 40% глюкозы внутривенно до восстановления сознания или уровня глюкозы в крови; согревании, витамино- и гормонотерапии; купировании судорог. Во время и после окончания курса лечения такие больные требуют мощной психической и физической реабилитации, которая может длиться до полугода после выписки из стационара, поэтому лечение проводится совместно гастроэнтерологом и психотерапевтом.
Прогноз и профилактика
Обычно заболевание без должного лечения приводит к летальному исходу в течение не больше чем 3-5 лет. При своевременно начатом лечении внешний эффект может быть достигнут достаточно быстро, однако восстановление функции внутренних органов может растянуться на годы. Профилактикой является пропаганда здорового образа жизни и правильного питания.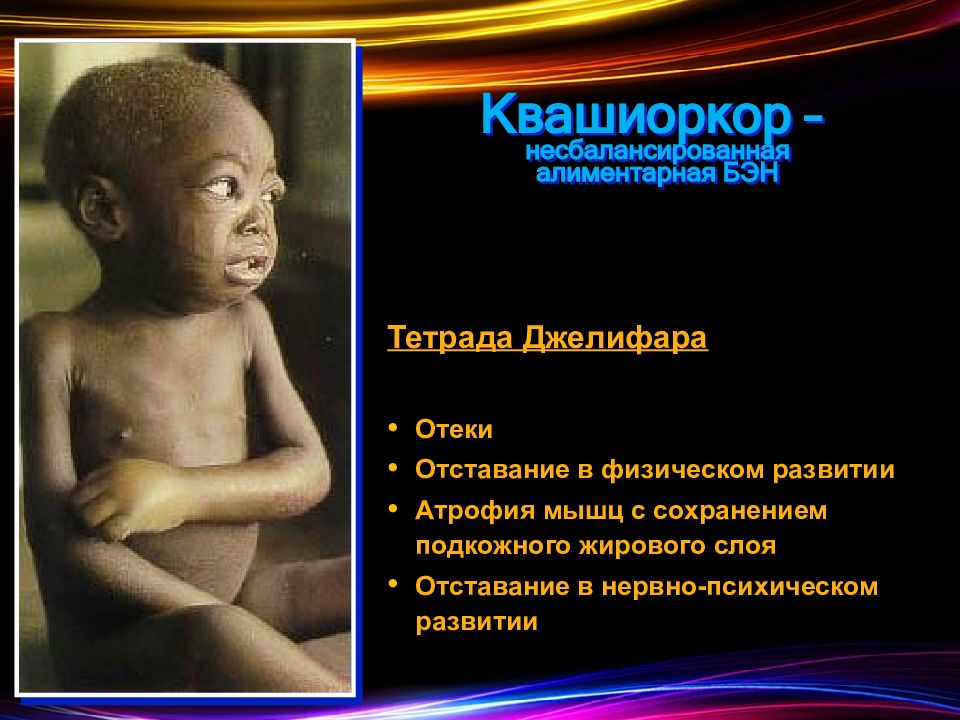
Алиментарная дистрофия (голодная болезнь, алиментарный маразм)
Виды
Выделено три основные стадии заболевания.
- Первая – общее состояние в норме. Мочеиспускание учащается до 20 раз в сутки, мучительные позывы. Снижается уровень питания, но беспокоит постоянный аппетит. Часто возникает потребность в приеме соли.
- Вторая – резкое похудание, ухудшается общее состояние. Добавляется вялость мышц, отеки ног, трудоспособность теряется, понижается температура тела. Психические расстройства и неуемный аппетит, жажда. Количество и частота мочеиспускания растет.
- Третья – характеризуется кахексией (глубокое истощение организма). Атрофируются мышцы, исчезает подкожная жировая клетчатка, апатия, психические расстройства, анемия, гиповитаминозы, запоры, пролежни, ацидоз (повышенное количество кислот в тканях и клетках), критическое состояние, угроза летального исхода.
Еще различают сухой и отечный алиментарный маразм.
Причины
Чаще всего алиментарный маразм встречается у грудных детей в результате недостаточного и неадекватного питания. Но распространены случаи дистрофии и у взрослых людей.
Факторы, приводящие к недугу:
- Намеренное голодание (на сегодняшний день треть населения планеты недовольны своей фигурой и гонка за идеалом становится манией).
- Несбалансированная пища, диеты – прямой путь к анорексии.
- Низкая калорийность пищи, недостающий ее объем (развивающиеся страны, бедность).
- Неправильное питание (употребление быстрых углеводов, которые не покрывают энергетических расходов).
- Неадекватная физическая нагрузка, холод, постоянный стресс.
Симптомы
Страдают все органы и системы. Начинает проявляться болезнь медленно.
Больной ест два-три раза в день, иногда реже. Количество пищи – 100-200 грамм. Исключаются из рациона молочные, мясные продукты, крупы и т.д. Нарастает раздражительность. Затем проявляются внешние признаки недуга. При отечной форме – отеки нижних конечностей, скопление жидкости в полостях и органах. При сухой – патологии сердечно-сосудистой системы и более выражена атрофия мышц.
При отечной форме – отеки нижних конечностей, скопление жидкости в полостях и органах. При сухой – патологии сердечно-сосудистой системы и более выражена атрофия мышц.
Общие проявления недуга – сухость кожи, ее бледность, желтизна, тусклые волосы, ломкие ногти, испортившиеся зубы.
Резкое истощение организма, висящие складки кожи на бедрах, животе. Язык малинового цвета с серым налетом, на краях видны отпечатки зубов. Снижение функции половых гормонов, у женщин отсутствуют месячные, у мужчин наблюдается импотенция. Расстройства пищеварения (запоры, поносы, рвота). Страдают все системы, организм истощается. Человек голоден, но не может принимать пищу, потому что размеры органов тоже сократились, их функции нарушились. Несвоевременное лечение может привести к летальному исходу.
Диагностика
Важно отличить дистрофию от ряда других заболеваний, таких как рак, психогенная анорексия, интоксикации химическими веществами, дисфункции желез и прочих. Анализ крови покажет анемию, низкое содержание белка.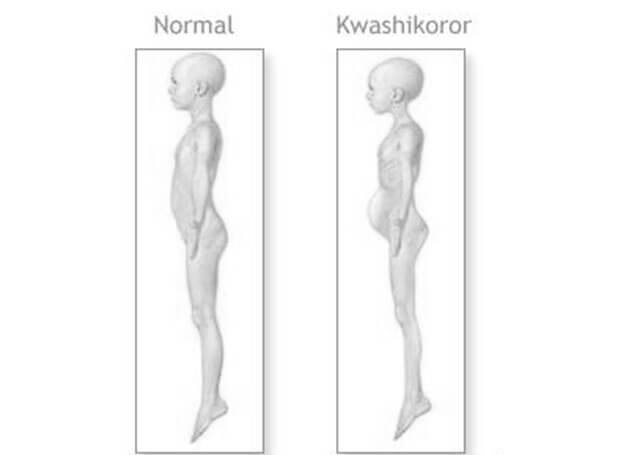 Артериальное давление и пульс будут намного ниже нормы. Глухие тоны сердца. При возникновении симптомов следует записаться на прием к врачу-терапевту.
Артериальное давление и пульс будут намного ниже нормы. Глухие тоны сердца. При возникновении симптомов следует записаться на прием к врачу-терапевту.
Лечение
На первой стадии достаточно будет организовать полноценный рацион, принимать пищу 5-6 раз в сутки, ограничить количество соли. В день нужно выпивать 1-1,5литра воды. Необходимо полное физическое и психическое спокойствие.
Вторая и третья стадии более серьезны и лечение предусматривает постельный режим, зондовое питание, внутривенные вливания глюкозы, плазмы и других компонентов крови. Ферментные препараты панкреатин, мезим. Симптоматическая терапия в зависимости от степени поражения.
Показана консультация терапевта, диетолога, психотерапевта, физиотерапевт. Осложнения, которые могут возникнуть: туберкулез, кишечные инфекции и т.д.
Профилактика
Показана энергетически сбалансированная диета. В реабилитационном периоде нужно заниматься лечебной физкультурой, работать с психологом.
Алиментарная дистрофия – это.
 .. Что такое Алиментарная дистрофия?
.. Что такое Алиментарная дистрофия?| Проверить информацию. Необходимо проверить точность фактов и достоверность сведений, изложенных в этой статье. |
Алиментарная дистрофия, алиментарный маразм — тяжелая форма белково-энергетической недостаточности (БЭН) с преобладанием энергетической недостаточности. Другие виды белково-энергетической недостаточности — это квашиоркор и кахексия.
Алиментарная дистрофия в основном наблюдается у детей до 1 года, в то время, как квашиоркор после 18 месяцев.
Распространенность
Этиология
Недостаточное поступление в организм и всасывание питательных веществ, обусловленное экзогенными, а также эндогенными причинами (опухолевое, рубцовое сужение пищевода, привратника, синдромы недостаточности пищеварения, всасывания). Имеют значение не только абсолютное, но и относительное (непропорциональное выполняемой физической работе) снижение калорийности пищи, качественные изменения пищевого рациона, особенно дефицит белков (главным образом животных), жиров; недостаток незаменимых аминокислот, жирных кислот и витаминов (в первую очередь жирорастворимых). При продолжительном недостатке питания возникают гипопротеинемия, дистрофические изменения в различных органах и тканях, нарушается функция многих органов, возникает полигландулярная недостаточность. Дистрофические изменения в стенке пищеварительного тракта и пищеварительных железах сопровождаются прогрессирующими нарушениями их функций и еще более усугубляют изменения обмена в организме..[источник не указан 448 дней]
При продолжительном недостатке питания возникают гипопротеинемия, дистрофические изменения в различных органах и тканях, нарушается функция многих органов, возникает полигландулярная недостаточность. Дистрофические изменения в стенке пищеварительного тракта и пищеварительных железах сопровождаются прогрессирующими нарушениями их функций и еще более усугубляют изменения обмена в организме..[источник не указан 448 дней]
Патогенез
Полное или частичное белковое голодание приводит к мобилизации белка костей, мышц, кожи, а при тяжелых состояниях – белка внутренних органов и в последнюю очередь – мозга.
Клинические проявления
Симптомы, общие для состояний белково-энергетической недостаточности — сухая кожа, свободные складки кожи, свисающие на бедрах, под мышками и т.д. Атрофия мышц и подкожной клетчатки, возможно также чередующиеся полосы пигментированных и депигментированных волос, пятна на коже, вызванные ее шелушением. Больной часто раздражен и ненасытно голоден.
Больной часто раздражен и ненасытно голоден.
Диагностика
Лечение
Лечение должно быть комплексным, поскольку сопутствующие инфекции, обезвоживание, и т.п часто смертельны.
В конечной стадии алиментарной дистрофии механизмы синтеза белка в организме разрушены, поэтому достаточное питание не предотвращает смертельный исход.
Прогноз
Благоприятен при своевременно начатом лечении.
Примечания
Литература
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 26 сентября 2011. |
Алиментарная дистрофия – Справочник заболеваний
По-другому это заболевание называется голодная болезнь, отечная болезнь. Причиной заболевания является алиментарное (пищевое) голодание, систематическое недоедание.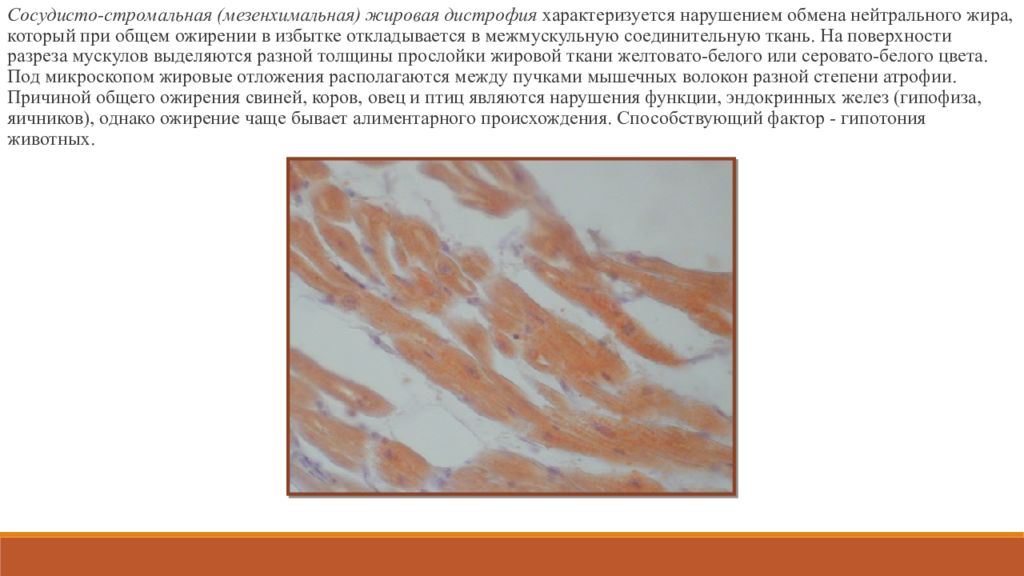
Общая информация
Алиментарная дистрофия была у жителей блокадного Ленинграда, где из-за отсутствия питания люди были настолько истощены, что падали и умирали от голода на улицах города. Сегодня алиментарная дистрофия возникает при тяжелых лихорадочных и токсических заболеваниях, при физическом, нервно-психическом перенапряжении. Возникает при недостаточном потреблении белков, жиров и углеводов.
В современных условиях выраженная алиментарная дистрофия встречается редко, если только человека держать в заточении без хлеба и воды длительный срок, или в случае тяжелого инфекционного заболевания у длительно болеющих туберкулезом легких. В странах Южной Африки, там, где очень низкий уровень жизни населения, можно видеть сильно истощенный людей.
Симптомы
При алиментарной дистрофии в её первой стадии истощаются энергетические ресурсы, запасы жиров и углеводов. Жировая прослойка становится тонкой, впоследствии совсем исчезает. Развивается слабость, повышенная утомляемость, стул нормальный или могут быть запоры. Аппетит больных может быть повышен. Во-вторую стадию происходит уменьшение белковых, клеточных и тканевых структур. Происходит прогрессирующее исхудание. При алиментарной дистрофии из-за дефицита белка, поступающего в организм в резко недостаточном количестве, происходит потребление собственного мышечного белка, происходят нарушения в работе всех органов и систем — эндокринной, иммунной, нарушается мыслительная деятельность. Иногда заболевание может протекать в отечной форме, когда у человека развиваются, так называемые «голодные отеки».
Аппетит больных может быть повышен. Во-вторую стадию происходит уменьшение белковых, клеточных и тканевых структур. Происходит прогрессирующее исхудание. При алиментарной дистрофии из-за дефицита белка, поступающего в организм в резко недостаточном количестве, происходит потребление собственного мышечного белка, происходят нарушения в работе всех органов и систем — эндокринной, иммунной, нарушается мыслительная деятельность. Иногда заболевание может протекать в отечной форме, когда у человека развиваются, так называемые «голодные отеки».
В третью стадию заболевания развивается кахексия. Истощаются мышцы, резко снижается эластичность кожи, страдают органы пищеварения, дыхания — развивается туберкулез легких, который носит прогрессирующее течение. Внешний вид человека не вызывает сомнения в постановке диагноза. Больной приобретает старческий вид, истощен, имеет желтого цвета кожные покровы. Он, в основном лежит, поджав ноги. Совсем нет сил передвигаться.
Профилактика
Профилактикой заболевания является умение вести здоровый образ жизни, правильное сочетание режима труда и отдыха, здоровый полноценный сон, занятия физкультурой и спортом, а также полноценное питание, богатое белком, жирами, углеводами, витаминами, минералами.
Лечение
На начальной стадии заболевания человеку необходимо полноценное питание, богатое белками, жирами, углеводами, витаминами. На второй стадии развития заболевания на первый план выходит белковое питание. Кормить человека следует не менее 6 раз в сутки. Необходимо, чтобы вместе с пищей больные получали достаточное количество витаминов группы В, С.
Лечить больного с кахексией необходимо внутривенными введениями белковых, витаминных препаратов. Можно вводить белковые вещества через зонд, непосредственно в желудок. Есть специальные белковые препараты, где кроме белка, содержатся витамины, минералы. Внутривенно вводят растворы синтетических аминокислот — мориамин С-2, альвезин, аминостерол, полиамин. Оказывая, положительное действие на белковый обмен и вызывая синтез белков, стабилизацию массы человека.
причины, симптомы, диагностика, лечение, профилактика
Алиментарная дистрофия представляет собой заболевание, которое характеризуется тяжелой формой белковой либо энергетической недостаточности.
Возникновение алиментарного маразма возможно на фоне продолжительного голодания, в следствии чего формируется существенная нехватка энергии и питательных веществ. В этом случае также обязательно учитывается их относительный дефицит, обоснованная несоответствием поступающих и расходующихся калорий. В принципе голодание может развиваться по самым разным причинам, однако усугублению патологического состояния способствует длительное переохлаждение и изнуряющий физический труд.
При постановке диагноза специалист должен учитывать, что возникновение дистрофии возможно только в случае длительного дефицита энергии. На начальном этапе недуга отмечается истощение запасов жиров и гликогена, после чего для обеспечения основного обмена расходуются запасы внутритканевого протеина. Сначала возникновение процессов дистрофии может наблюдаться в тканях и мышцах, после чего активируются внутренние органы, но в определенный момент процессы катаболизма приобретает такую форму, что смерть человека неизбежна даже при нормализации питания.
На последней фазе в организме человека наблюдается истощение минерально-витаминных запасов, а также прекращение деятельности иммунной системы. Возникновение смерти у таких больных связывают с возникновением тяжелой степени сердечной недостаточности либо присоединением тяжелых инфекционных поражений, обусловленных угнетением работы иммунной системы.
СимптомыАлиментарная дистрофия отличается медленным течением, в некоторых случаях больные даже могут не подозревать о наличии у него данного заболевания. Чаще всего первые признаки кахексии формируются только после продолжительного дефицита поступления в организм питательных веществ. Иногда первые симптомы недуга не связывают с угрожающим жизни состоянием. На начальном этапе у больного отмечается учащенное мочеиспускание, обусловленное увеличением суточного количества мочи, повышенная утомляемость, раздражительность и выраженная сонливость. Таких больных постоянно мучает жажда и усиленный аппетит. Одним из специфических признаков недуга, является предрасположенность к поеданию соли.
При отсутствии нормального питания у таких больных отмечается возникновения дряблости и повышенной сухости кожных покровов. Больные могут с большим трудом выполнять работу связанную даже с незначительными физическими нагрузками. На этой стадии отмечается нарушение работы внутренних органов, гипотермия, урежение сердцебиения и гипотония, а также возникновение некоторых нарушений психики.
На последней этапе отмечается быстрое угнетение работы всех жизненно важных органов, полное отсутствие подкожно-жировой клетчатки, истончение и дряблость мышц. Летальный исход пациентов, которые находятся на последней стадии недуга даже в случае начала корректного лечения.
ДиагностикаДиагноз выставляется после сбора анамнеза и осмотра. Специалиста должно насторожить, если в анамнезе больного есть сведения, указывающие на продолжительный дефицит питания, а также у него имеется типичная для недуга симптоматика. Для подтверждения диагноза таким больным могут быть назначены общий и биохимический анализ крови, ультразвуковое исследование внутренних органов, компьютерная или магниторезонансная томография.
Лечение патологического состояния следует начинать с нормализации режима дня, повышения качества питания и обеспечения рационального отдыха. Такие пациенты проходят курс терапии в теплой хорошо проветриваемой палате, при этом потребуется исключить контакт с инфицированными лицами. При первой стадии назначают дробный прием легко устраиваемых продуктов питания. Больные на второй и третьей стадии могут получать питание как через зонд, так и инфузионного введения растворов глюкозы и других лекарственных средств.
Таким больным проводится коррекция работы иммунной системы, а также назначается физическая и психологическая реабилитация.
ПрофилактикаСоблюдение рационального питания и отказ от жестких диет помогут предупредить развитие алиментарной дистрофии.
Голодная болезнь в Освенциме | Медицинское обозрение Освенцим
Одним из самых громких экспериментов, проведенных над заключенными Освенцима, была болезнь голода, вызванная недостаточным качеством и количеством пищи.
Основной пищей для женщин-заключенных в лагере Биркенау был кусок хлеба с шариком джема или крошечный кусочек маргарина, или, реже, ломтик колбасы или соленый творожный сыр, выдаваемый вечером, и несладкий черный кофе, или чаще «Листовой» чай, утром, конечно, без хлеба.В полдень заключенные получили тарелку супа, приготовленного из пищевого экстракта аво. 1 В эксперименте с крысами, которых кормили диетой, смоделированной по образцу пищи концентрационного лагеря, у животных развился типичный синдром голодной болезни в течение трех месяцев, даже если количество пищи не было ограничено.
В лагерных условиях ситуация, конечно, усугублялась количественными ограничениями, а также тем, что лагерные бандиты воровали обычные пайки заключенных.
В результате недоедания заключенные Освенцима страдали от дефицита калорий, особенно животных белков и жиров, а также от комбинированного дефицита витаминов.
В первые недели голодной болезни Освенцима наблюдался начальный период, который можно было бы назвать периодом компенсации. Организм поддерживал свои потребности в энергии (глюкозе) за счет собственных тканевых резервов. Истощив свои краткосрочные запасы гликогена, пациенты метаболизировали нижележащий слой жировой ткани и, наконец, свои мышечные белки и ткани своих внутренних органов. В результате их тело было сильно истощено, что сопровождалось сокращением мышц и тканей органов.Их вес свидетельствовал о степени истощения: по данным Комиссии по расследованию преступлений Германии 2 Вес заключенной № А 27859, рост которой составлял 155 см, составлял 23 кг, в то время как женщина-заключенная № 44884, рост 160 см, весила 25 кг. Из-за обширной атрофии мышц пациенты буквально выглядели как мешок с костями. Иногда их исхудание в значительной степени маскировалось голодом. Постепенно голод перерос в свою полную форму, которую иногда называют алиментарной дистрофией.
Организм поддерживал свои потребности в энергии (глюкозе) за счет собственных тканевых резервов. Истощив свои краткосрочные запасы гликогена, пациенты метаболизировали нижележащий слой жировой ткани и, наконец, свои мышечные белки и ткани своих внутренних органов. В результате их тело было сильно истощено, что сопровождалось сокращением мышц и тканей органов.Их вес свидетельствовал о степени истощения: по данным Комиссии по расследованию преступлений Германии 2 Вес заключенной № А 27859, рост которой составлял 155 см, составлял 23 кг, в то время как женщина-заключенная № 44884, рост 160 см, весила 25 кг. Из-за обширной атрофии мышц пациенты буквально выглядели как мешок с костями. Иногда их исхудание в значительной степени маскировалось голодом. Постепенно голод перерос в свою полную форму, которую иногда называют алиментарной дистрофией.
Изменения в пищеварительном тракте приводили к нарушениям пищеварения и диарее, что препятствовало усвоению даже некачественной пищи и усугубляло недоедание. Это заманивало заключенных в порочный круг, снижая их шансы в полной мере использовать имеющуюся пищу.
Это заманивало заключенных в порочный круг, снижая их шансы в полной мере использовать имеющуюся пищу.
Детальная оценка отдельных аспектов голода не всегда была простой. Я смог понять некоторые конкретные изменения, которые я наблюдал во время своего пребывания в лагере, только после того, как меня выпустили и прочитали соответствующую медицинскую литературу.В экспериментах на животных отбирают определенные пищевые ингредиенты, и тогда легче оценить симптомы. Но в этом ужасающем массовом эксперименте на людях совпали ряд факторов, вызывающих болезнь, что исказило клиническую картину. Более того, болезнь голода не всегда протекала одинаково у всех и зависела от конкретных обстоятельств. Часто это сопровождалось такими осложнениями, как тиф, гнойные инфекции или травмы.
Тем не менее, типичный синдром обнаружил некоторые очень характерные изменения, которые я постараюсь обсудить.К ним относились истощение, о котором говорилось выше, кэмп-диарея, отек мягких тканей, другие кожные изменения и нарушения нервной системы.
Лагерная диарея, пресловутый Durchfall , была обычным патологическим изменением, с которым сталкивался почти каждый заключенный. Ранняя диарея, которая наблюдалась у большинства заключенных, была в основном ферментативной или инфекционной и прошла относительно быстро. Durchfall , собственно понос, развивается у голодных и тяжело больных заключенных и обычно заканчивается смертью.Инфекционная природа этой диареи не может быть исключена во всех случаях с полной уверенностью, но поскольку она обычно не уменьшалась в ответ на антибактериальные препараты, а только при улучшении приема пищи, ее можно рассматривать как результат недоедания. Радикальное изменение диеты, особенно когда заключенный получил посылку из дома, может привести к резкому ухудшению здоровья заключенного; Я наблюдал это явление несколько раз. Простейшее объяснение патогенеза лагерной диареи состоит в том, что она возникла из-за нехватки полезных питательных веществ, в частности белков и тиамина, как можно заключить, наблюдая аналогичные процессы у животных.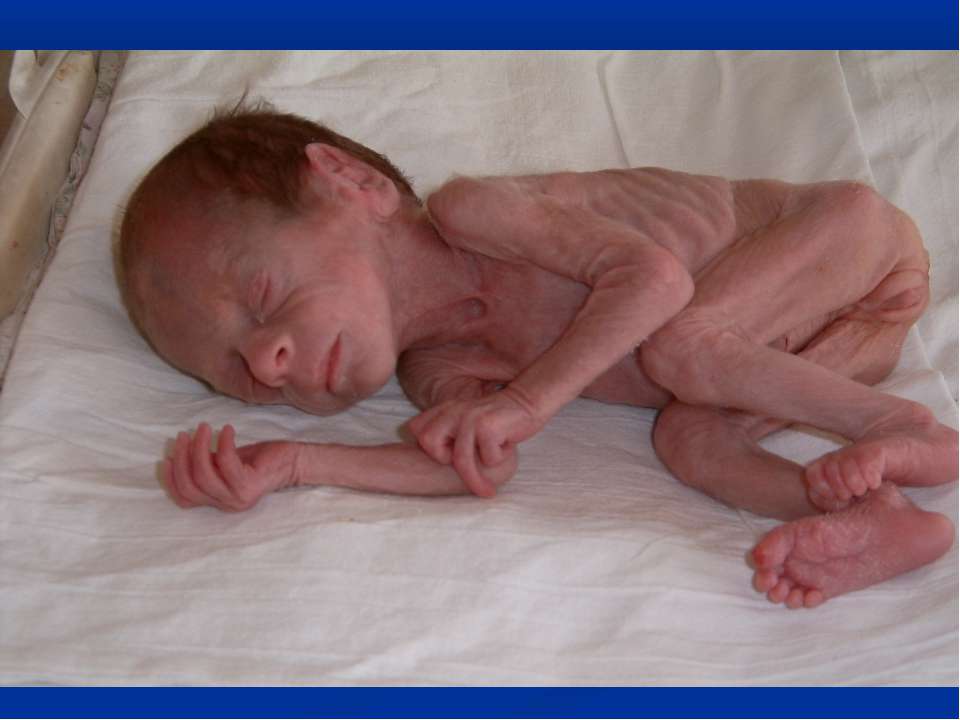 Вначале слизистые оболочки опухают, вызывая дальнейшее ухудшение процесса пищеварения. В ходе болезни фекалии, изначально пенистые и зеленоватые, становятся зловонными, а затем становятся водянистыми и смешанными с кровью, с последующим выделением очень частыми и иногда непроизвольными. Слизистая оболочка, которая изначально только набухла, покрывается корками, а затем изъязвляется, что приводит к состоянию, очень похожему на шигеллез.
Вначале слизистые оболочки опухают, вызывая дальнейшее ухудшение процесса пищеварения. В ходе болезни фекалии, изначально пенистые и зеленоватые, становятся зловонными, а затем становятся водянистыми и смешанными с кровью, с последующим выделением очень частыми и иногда непроизвольными. Слизистая оболочка, которая изначально только набухла, покрывается корками, а затем изъязвляется, что приводит к состоянию, очень похожему на шигеллез.
Отеки на нижних конечностях, которые иногда доходили до туловища, затронули не всех заключенных.Было две формы голода: одна с отеком (отеком) и «сухая» форма без отека, и я не могу найти объяснения – ни на основе личного опыта, ни на основе профессиональной литературы – когда и почему именно форма произошла. Опухшая форма обычно связана с гипопротеинемией, в первую очередь из-за недостаточного потребления белка. По словам Лейтона, гипопротеинемический отек уменьшается после внутривенного введения белка. У русских женщин в Биркенау, которые любили менять творожный сыр или кусок колбасы на большую по объему тарелку супа, опухание появлялось гораздо чаще, чем у других заключенных. Напротив, заключенные с сухой формой истощения в питании, безусловно, должны были страдать от гипопротеинемии, но, несмотря на это, не испытывали отеков, которым я не могу найти убедительного объяснения на основе своих наблюдений. Усиление отеков на нижних конечностях следует рассматривать как совокупность осмотических и гидростатических факторов при гипопротеинемии. Некоторое значение могло иметь и увеличение проницаемости сосудистых стенок.
Напротив, заключенные с сухой формой истощения в питании, безусловно, должны были страдать от гипопротеинемии, но, несмотря на это, не испытывали отеков, которым я не могу найти убедительного объяснения на основе своих наблюдений. Усиление отеков на нижних конечностях следует рассматривать как совокупность осмотических и гидростатических факторов при гипопротеинемии. Некоторое значение могло иметь и увеличение проницаемости сосудистых стенок.
С точки зрения патогенеза не совсем ясно, что стало причиной появления крупных субэпидермальных волдырей, заполненных серозной жидкостью.Волдыри также появились на конечностях, особенно на голенях, локтях и плечах. Не исключено, что причиной субэпидермальных волдырей была аналогичная причина отеков кожи. Они наблюдались у сильно истощенных пациентов с субэпидермальной атрофией; возможно, эта атрофия может объяснить тенденцию сыворотки проникать в субэпидермис и образовывать волдыри. Мы не наблюдали значительного количества местного воспаления, когда волдыри были оторваны шероховатой поверхностью одеял или соломенных матрасов, и тело заключенного не реагировало. В случаях гипопротеинемии, первой стадией которой является гипоальбуминемия, за которой следует гипоглобулинемия, способность организма вырабатывать антитела значительно снижалась всякий раз, когда возникала инфекция, и, следовательно, многие инфекции, особенно гнойные, были анергическими.
В случаях гипопротеинемии, первой стадией которой является гипоальбуминемия, за которой следует гипоглобулинемия, способность организма вырабатывать антитела значительно снижалась всякий раз, когда возникала инфекция, и, следовательно, многие инфекции, особенно гнойные, были анергическими.
Другие изменения, наблюдаемые в слоях кожи, были эритематозными, которые иногда становились более острыми в весенние месяцы. Эти состояния имели тенденцию быть пеллагроидными и были связаны с дефицитом ниацина.
Массовое поседение волос у молодых заключенных должно быть связано с нехваткой пищи, скорее всего, с нехваткой пантотеновой кислоты.Есть очевидные аналогии с экспериментами, проводимыми на собаках и крысах, которые становятся серыми при голодании, но восстанавливают свой черный мех, когда возобновляется их правильная диета. Николс описал аналогичные наблюдения у голодающих детей, которые позже вернули свой первоначальный цвет волос.
То, что я лично видел меньше, так это появление коричневатого цвета кожи, напоминающего болезнь Аддисона, в то время как иногда я наблюдал атрофические изменения в эпидермисе, особенно в уголках рта, с вторичными потерями из-за образования струпов, которые напоминали angulus influenctiosus (воспаление губ), но имел другой патогенез ( хейлоз, , сухое шелушение и трещины на губах).
Кроме того, имелся ряд других интересных деталей, которые можно было идентифицировать в клинической картине голода. Например, одной из поразительных черт, наблюдаемых у пожилых заключенных-женщин, был их глухой, приглушенный, хриплый голос. Это изменение, возможно, также можно объяснить нехваткой витамина А в сочетании с повреждением многослойного плоского эпителия.
С другой стороны, было бы труднее объяснить аменорею, обычно наблюдаемую у заключенных, исключительно из-за недоедания; умственные процессы, в основном постоянное чувство ужаса и просто страха, имели в этом отношении огромное значение.Аменорея также встречалась у женщин, которые кормились лучше, но жили в условиях концентрационного лагеря или тюрьмы.
Особенно характерны были симптомы расстройств нервной системы, как психических, так и неврологических. По мере того как похудение прогрессировало, психологические изменения заключенных также усиливались: их отчаяние и апатия, а также их сонливость усиливались. Все их реакции замедлились, а больные заключенные гораздо медленнее выполняли приказы. Их медленная реакция на приказы часто вызывала приступы гнева со стороны охранников, которые считали поведение заключенных демонстрацией пассивного сопротивления.Больные заключенные становились все слабее и слабее, их лица становились похожими на маски, и они предпочитали сидеть на корточках. Такие заключенные обычно назывались Muselmänner . Всегда холодные и с накинутым на тело одеялом, они были характерным зрелищем.
Все их реакции замедлились, а больные заключенные гораздо медленнее выполняли приказы. Их медленная реакция на приказы часто вызывала приступы гнева со стороны охранников, которые считали поведение заключенных демонстрацией пассивного сопротивления.Больные заключенные становились все слабее и слабее, их лица становились похожими на маски, и они предпочитали сидеть на корточках. Такие заключенные обычно назывались Muselmänner . Всегда холодные и с накинутым на тело одеялом, они были характерным зрелищем.
Была еще одна причина сидеть на корточках. Некоторые пациенты страдали болями в нижних конечностях. Пейдж описал это как синдром болезненных стоп. Поверхность стоп была болезненной, поэтому при ходьбе пациенты, как правило, опирались на внешние края стопы, что заставляло их ковылять.Сообщалось, что состояние ухудшалось ночью и при изменении погоды. Несмотря на значительную слабость в нижних конечностях, пациенты чувствовали себя лучше, сидя на корточках. Они также могут испытывать спастические состояния в мышцах, сенсорные расстройства и изменения рефлексов. Все эти изменения можно объяснить демиелинизацией нервных волокон и частичным повреждением аксонов, что связано с дефицитом витаминов группы B, 3 , особенно тиамина.
Все эти изменения можно объяснить демиелинизацией нервных волокон и частичным повреждением аксонов, что связано с дефицитом витаминов группы B, 3 , особенно тиамина.
У женщин Биркенау явно наблюдались сенсорные расстройства.Измученные голодом, ослабленные болезнями, постоянно замерзшие, всякий раз, когда они были в помещении, они стекались к печи, которая была больше похожа на кирпичную дымовую трубу, идущую горизонтально вдоль барака. Больные заключенные часто сидели на дымоходе, как на скамейке. В результате у них появились серьезные ожоги, даже ожоги 3-й степени, на ягодицах и тыльной стороне бедер. Но иногда они даже не чувствовали себя обожженными. Тот факт, что ожоги тканей происходили намного легче у людей, у которых были повреждены капилляры, был еще одним аспектом этого вопроса.
Я видел случай сильно истощенной пациентки, ноги которой ночью обгрызли крысы, оставив только голые сухожилия на поверхности ступней – но она все равно не отреагировала. После того, как ее раны были перевязаны, она прожила еще два дня. Митчелл и Блэк также наблюдали сенсорные расстройства; Льюис и Массельманн наблюдали, что изменения в центральной нервной системе отступили после введения никотиновой кислоты, в то время как изменения в периферических нервах отступили после введения тиамина.Изменения коснулись и слуховых нервов, поэтому слух пациентов был приглушен; они жаловались на постоянное гудение или звон в ушах.
Митчелл и Блэк также наблюдали сенсорные расстройства; Льюис и Массельманн наблюдали, что изменения в центральной нервной системе отступили после введения никотиновой кислоты, в то время как изменения в периферических нервах отступили после введения тиамина.Изменения коснулись и слуховых нервов, поэтому слух пациентов был приглушен; они жаловались на постоянное гудение или звон в ушах.
Можно также перечислить многие другие симптомы многогранного комплекса голода и попытаться объяснить их патогенез. Это невозможно сделать в кратком обзоре, и это не было моей целью. Я намеревался вспомнить ужасный эксперимент с искусственно вызванным голодом у заключенных Освенцима.
Перевод оригинальной статьи: Kowalczykowa, J., «Choroba głodowa w obozie koncentracyjnym w Oświęcimiu.» Przegląd Lekarski – Освенцим , 1961
Банкноты
- Экстракт сорняков или рыбной муки.
- Główna Komisja Badania Zbrodni Niemieckich w Polsce , центральный польский орган по расследованию военных преступлений Германии, созданный в 1945 году.

- Т.е. бери-бери.
Список литературы
1. Льюис, К. Ф., и Массельманн,?. ? Наблюдения за пеллагрой у американских военнопленных на Филиппинах. Журнал питания . 1946; 32 (5): 549–558.2. Лейтон,?. G. Последствия медленного голодания. Ланцет . 1946; 2 (6412): 73–79.
3. Митчелл Дж. Б. и Блэк Дж. А. Недоедание у освобожденных военнопленных и интернированных в Сингапуре. Ланцет . 1946; 2 (6433): 855–862.
4. Николлс, Люциус. Седые волосы у плохо питающихся детей. Ланцет . 1946; 2 (6415): 201.
5. Пейдж, Дж. А. Синдром боли в ногах у военнопленных на Дальнем Востоке. Британский медицинский журнал . 1946; 2: 260–262.
Алиментарная дистрофия – причины, симптомы и лечение
Алиментарная дистрофия – заболевание, характеризующееся тяжелой белковостью и чаще всего более выраженной энергетической недостаточностью. Проявления могут быть самыми разнообразными, основные – потеря массы тела более 20% (или ИМТ менее 16), сухость и дряблость кожи, ломкость волос и ногтей, вялость, сонливость и слабость, повышенный аппетит. Диагностика основывается в основном на анамнезе, сочетании объективных и субъективных признаков, а также на исключении других заболеваний. Лечение комплексное, заключается в корректировке питания и восстановлении запасов питательных веществ, витаминов и минералов в организме.
Диагностика основывается в основном на анамнезе, сочетании объективных и субъективных признаков, а также на исключении других заболеваний. Лечение комплексное, заключается в корректировке питания и восстановлении запасов питательных веществ, витаминов и минералов в организме.
Алиментарная дистрофия (алиментарный маразм) – это социальное заболевание, которое может развиться в результате вынужденного или сознательного голодания. Сегодня пищевой маразм у людей не только в развивающихся странах, во время войн и аварий – а это более полумиллиона человек.Многие готовы осознанно морить себя голодом в погоне за красивой фигурой и радовать свои комплексы. Однако болезнь может иметь серьезные последствия, вплоть до летального исхода. При длительном голодании, недостаточном поступлении в организм незаменимых веществ могут произойти необратимые изменения обменных процессов. В развитых странах все чаще можно услышать о случаях анорексии – и это все та же алиментарная дистрофия тяжелой степени.
Причины алиментарной дистрофии
Причиной пищевого маразма служит длительное голодание, во время которого в организм поступает недостаточное количество питательных веществ и энергии.При этом учитывается и их относительная недостаточность: когда поступление калорий не соответствует их расходу. Голод может наступить по разным причинам (война, экологическая катастрофа и другие случаи, когда человек вынужденно долго не получает пищи; диеты; сужение и рубцы пищевода и др.), Однако обострение процесса провоцируется тяжелым физическим трудом, переохлаждением. .
Следует отметить, что развитие дистрофии возможно только при длительном энергетическом голодании.При этом в организме сначала полностью истощаются запасы гликогена и жиров, затем для обеспечения основных обменных резервов межуточного белка используются. В первую очередь процессы дистрофии начинаются в коже, мышцах, затем вовлекаются внутренние органы, в последнюю очередь – жизненно важные (сердце, почки и мозг). В какой-то момент процессы катаболизма принимают такую форму, что летальный исход становится неизбежным даже при начале полного излечения.
В какой-то момент процессы катаболизма принимают такую форму, что летальный исход становится неизбежным даже при начале полного излечения.
На последних стадиях заболевания в организме истощаются запасы витаминов и минералов, перестает функционировать иммунная система.Летальный исход обычно наступает либо от сердечной недостаточности, либо от присоединенной инфекции на фоне значительного угнетения иммунитета.
Классификация алиментарной дистрофии
В гастроэнтерологии принято делить алиментарную дистрофию как по формам, так и по массе. По форме заболевание делится на кахектическое (сухое) и отечное. Кахектическая форма имеет более неблагоприятное течение. Отечная форма характеризуется развитием распространенных отеков, в том числе внутренних (асцит, перикардит и плеврит), эта форма лучше поддается лечению.
По степени тяжести заболевания различают три стадии. На первом этапе отмечается незначительное снижение массы тела, сохранение работоспособности наряду с появлением жалоб на более частые мочеиспускания, жажду и повышение аппетита, озноб и слабость. На втором этапе отмечается значительное исхудание с потерей работоспособности. Такие пациенты еще могут сами себя обслуживать, но практически не трудоспособны. Могут быть отеки, значительно снижается уровень белка, часто бывают эпизоды понижения уровня глюкозы крови.На третьем этапе больные больше не могут самостоятельно двигаться и вставать с постели, резко истощены. При появлении голодной комы даже у пациента, ранее сохранившего трудоспособность, говорят о третьей стадии заболевания.
На втором этапе отмечается значительное исхудание с потерей работоспособности. Такие пациенты еще могут сами себя обслуживать, но практически не трудоспособны. Могут быть отеки, значительно снижается уровень белка, часто бывают эпизоды понижения уровня глюкозы крови.На третьем этапе больные больше не могут самостоятельно двигаться и вставать с постели, резко истощены. При появлении голодной комы даже у пациента, ранее сохранившего трудоспособность, говорят о третьей стадии заболевания.
Симптомы алиментарной дистрофии
Алиментарная дистрофия развивается постепенно, довольно часто больной не может осознавать, что у него это заболевание. Обычно первые признаки кахексии проявляются только после длительного ограничения поступления в организм не только калорий, но и белка, жиров, незаменимых аминокислот и витаминов (чаще жирорастворимых).Первые симптомы можно не замечать или не расценивать как опасные: учащение мочеиспускания, полиурия (увеличение суточного объема мочи), слабость и раздражительность, снижение работоспособности, постоянная сонливость. Часто беспокоит жажда, повышенный аппетит. Один из специфических симптомов – склонность к поеданию соли.
Часто беспокоит жажда, повышенный аппетит. Один из специфических симптомов – склонность к поеданию соли.
Если питание не налажено, болезнь прогрессирует и переходит в следующую стадию. При этом кожа становится очень дряблой и сухой, обвисает складками, напоминает пергамент.Совершать какие-либо физические нагрузки становится очень тяжело, сильно страдает общее состояние. Появляются первые симптомы дистрофии и нарушения функционирования внутренних органов (запоры и другие диспепсические проявления, нарушения работы сердца, эндокринные нарушения – у женщин пропадают периоды, наступает бесплодие). Отмечается склонность к понижению температуры. Сердцебиение урежатся, давление пониженное. Могут быть изменения в менталитете.
Последняя стадия заболевания характеризуется ярким проявлением угасания всей функции организма.Подкожно-жировая прослойка отсутствует, мышцы становятся очень тонкими и дряблыми. Самостоятельно человек на третьем этапе больше не способен двигаться. Отмечается снижение уровня всех клеток крови (эритроцитов, лейкоцитов, тромбоцитов), подавлен иммунитет. В крови отмечается очень низкий уровень белка, тенденция к снижению уровня глюкозы. Запасы витаминов и минералов полностью истощаются, кости становятся хрупкими. Поскольку организм запускает катаболизм (разрушение) собственных белков, в крови начинают накапливаться ядовитые продукты их распада.Это приводит к большему ухудшению состояния, появлению выраженных психических расстройств (результат действия продуктов распада на мозг). Обычно на последних стадиях болезни даже начало лечения и еда не могут предотвратить печальный исход.
Отмечается снижение уровня всех клеток крови (эритроцитов, лейкоцитов, тромбоцитов), подавлен иммунитет. В крови отмечается очень низкий уровень белка, тенденция к снижению уровня глюкозы. Запасы витаминов и минералов полностью истощаются, кости становятся хрупкими. Поскольку организм запускает катаболизм (разрушение) собственных белков, в крови начинают накапливаться ядовитые продукты их распада.Это приводит к большему ухудшению состояния, появлению выраженных психических расстройств (результат действия продуктов распада на мозг). Обычно на последних стадиях болезни даже начало лечения и еда не могут предотвратить печальный исход.
Самое тяжелое состояние, которое развивается на последних стадиях алиментарной дистрофии – голодная кома. Происходит это из-за значительного снижения уровня глюкозы в крови и невозможности обеспечить мозг необходимым количеством энергии.Клиника этого состояния достаточно яркая: внезапная потеря сознания, бледность и похолодание кожи, зрачки широкие. Температура тела значительно снижена. Дыхание поверхностное, может быть редким и спазматическим. В мышцах нет тонуса, возможны спазмы. Пульс практически не определяется, слабый, давление невысокое. Если вовремя не оказать помощь, смерть наступит от прекращения сердечной деятельности и дыхания.
Температура тела значительно снижена. Дыхание поверхностное, может быть редким и спазматическим. В мышцах нет тонуса, возможны спазмы. Пульс практически не определяется, слабый, давление невысокое. Если вовремя не оказать помощь, смерть наступит от прекращения сердечной деятельности и дыхания.
Также течение алиментарной дистрофии может осложняться присоединением различных инфекций (кишечные, туберкулез, пневмония, сепсис).Нередко смерть наступает от эмболии тромбами легочной артерии (ТЭЛА), при перенапряжении во время физических нагрузок.
Диагностика алиментарной дистрофии
Диагноз может быть выставлен на основании тщательного сбора анамнеза и осмотра пациента. Если в анамнезе есть указания на длительное голодание, то имеется симптоматика, характерная для алиментарной дистрофии, и лабораторные показатели (развернутые клинико-биохимические анализы крови, симптомы дистрофии внутренних органов на УЗИ, КТ или МРТ), а также исключены другие заболевания, диагностика не представляет затруднений.
Пищеварительную дистрофию необходимо дифференцировать с другими заболеваниями, которые могут привести к истощению организма: онкологическими процессами (прежде всего раком желудка и кишечника), туберкулезом, сахарным диабетом, гипофизарными расстройствами и тиреотоксикозом. Алиментарная дистрофия от других заболеваний отличается выраженным усилением жажды и аппетита, голодом, очень сильным истощением мышц и изменением кожи, брадикардией и снижением температуры тела, нарушением работы всех желез внутренней секреции.
Лечение алиментарной дистрофии
Лечение этого заболевания на любом этапе начинают с нормализации режима дня, питания, отдыха и сна. Таких больных помещают в теплую проветриваемую камеру, не допуская контакта с инфекционными больными. На первой стадии заболевания начинайте дробное питание с легко усваиваемой пищи. На втором и третьем этапе питание осуществляется как энтерально (энпита – специальные питательные смеси), так и парентерально путем введения растворов глюкозы и других питательных веществ внутривенно.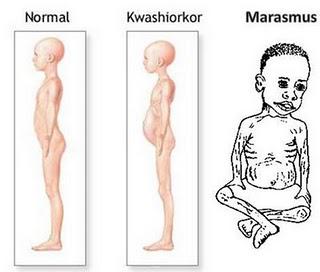
Калорийность должна составлять для начала около 3000 ккал / сутки, постепенно доводя до 4500 ккал / сутки. В рацион обязательно включается животный белок, общее количество белка должно составлять 2 г / кг / сут. Заливать нужно не только питательные вещества, но и жидкость путем вливания различных растворов. На третьем этапе обязательно проводятся переливания лекарственных средств крови (эритроцитов и плазмы, альбумина). Корректируется кислотно-щелочное состояние организма.
Для лечения инфекционных осложнений вводят антибиотики (в зависимости от чувствительности).Также производится коррекция иммунного статуса, дисбактериоза. Лечение алиментарной комы заключается во введении 40% раствора глюкозы внутривенно до восстановления сознания или уровня глюкозы в крови; согревание, витаминная и гормональная терапия; купирование судорог. Во время и после окончания курса лечения такие пациенты требуют мощной психической и физической реабилитации, которая может длиться до полугода после выписки из стационара, поэтому лечение проводится совместно гастроэнтерологом и психотерапевтом.
Прогноз и профилактика
Обычно заболевание без должного лечения приводит к летальному исходу в течение не более 3-5 лет. При своевременно начатом лечении внешний эффект может быть достигнут достаточно быстро, однако восстановление функции внутренних органов может затянуться на годы. Профилактика – это пропаганда здорового образа жизни и здорового питания.
Дисфункция желудочно-кишечного тракта у пациентов с мышечной дистрофией Дюшенна
Аннотация
Фон
Сообщалось об опасном для жизни запоре у взрослых пациентов с мышечной дистрофией Дюшенна (МДД).Поскольку функция желудочно-кишечного тракта при МДД не была тщательно изучена, мы исследовали объективные и субъективные проявления желудочно-кишечных расстройств у пациентов с МДД.
Методы
У 33 пациентов с МДД в возрасте от 12 до 41 года пищевое поведение и желудочно-кишечные симптомы оценивались с помощью анкет. Половина опорожнения желудка (T 1/2 ) и время прохождения через рото-слепой канал (OCTT) оценивали путем анализа кривых выдоха 13 CO 2 после приема 13 C тестовых обедов. Время прохождения через толстую кишку (СТТ) измеряли с помощью рентгенографии брюшной полости после приема рентгеноконтрастных маркеров.
Время прохождения через толстую кишку (СТТ) измеряли с помощью рентгенографии брюшной полости после приема рентгеноконтрастных маркеров.
Результаты
Медиана (квартили) T 1/2 составляла 187 (168, 220) минут, OCTT составляла 6,3 (5,0, 7,9) часа, что значительно дольше обычных данных (Goetze 2005, T 1/2 : 107 ± 10; Гейпенс 1999, OCTT 4,3 ± 0,1 часа). Медиана CTT составляла 60 (48, 82) часов, несмотря на широкое применение слабительных средств (Meier 1995, верхний предел нормы: 60 часов). T 1/2 и OCTT не коррелировали с симптомами, оцениваемыми с помощью индекса кардинальных симптомов гастропареза (GCSI) (Spearman r = -0.3, p = 0,1; и r = -0,15, p = 0,4 соответственно). CTT не коррелировал с симптомами запора, оцененными по критериям ROME III (r = 0,12, p = 0,5).
Выводы
У пациентов с МДД заметно нарушена моторная функция желудочно-кишечного тракта. Поскольку объективные измерения нарушения желудочно-кишечного транспорта не коррелируют с симптомами гастропареза или запора, наши результаты показывают, что меры, обеспечивающие адекватный кишечный транспорт, должны приниматься независимо от восприятия пациента, чтобы предотвратить потенциально опасный для жизни запор, особенно у пожилых пациентов с МДД.
Образец цитирования: Lo Cascio CM, Goetze O, Latshang TD, Bluemel S, Frauenfelder T, Bloch KE (2016) Желудочно-кишечная дисфункция у пациентов с мышечной дистрофией Дюшенна. PLoS ONE 11 (10): e0163779. https://doi.org/10.1371/journal.pone.0163779
Редактор: Маурилио Сампаолези, Katholieke Universiteit Leuven, БЕЛЬГИЯ
Поступила: 6 мая 2016 г .; Одобрена: 14 сентября 2016 г .; Опубликовано: 13 октября 2016 г.
Авторские права: © 2016 Lo Cascio et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файле вспомогательной информации.
Финансирование: Эта работа была поддержана Цюрихской лигой легких (http://www.lunge-zuerich.ch, номер гранта не указан), CML, KEB.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Мышечная дистрофия Дюшенна (МДД) – наиболее распространенная форма наследственных мышечных дистрофий, поражающая примерно одного из 3300 новорожденных мальчиков. Заболевание вызвано мутациями в гене, расположенном в Xp21, который кодирует белок дистрофин.МДД приводит к прогрессирующей мышечной слабости, тяжелой физической инвалидности и, в конечном итоге, к смерти. [1, 2] Большинство пациентов с МДД становятся прикованными к инвалидной коляске в детстве, и в своей повседневной деятельности и уходе они во многом зависят от своих родителей или опекунов. [3, 4] На более поздних стадиях заболевания прогрессирующая деформация позвоночника и грудной стенки и нарушение функции дыхательных мышц приводят к гиперкапнической дыхательной недостаточности примерно в возрасте 20 лет, а поражение сердечной мышцы может привести к застойной сердечной недостаточности.[5] Неинвазивная вентиляция с положительным давлением и другие поддерживающие меры продлевают выживаемость пациентов с МДД [6], которые сообщают об удивительно высоком качестве жизни в областях, напрямую не связанных с их физическими нарушениями. [6]
[3, 4] На более поздних стадиях заболевания прогрессирующая деформация позвоночника и грудной стенки и нарушение функции дыхательных мышц приводят к гиперкапнической дыхательной недостаточности примерно в возрасте 20 лет, а поражение сердечной мышцы может привести к застойной сердечной недостаточности.[5] Неинвазивная вентиляция с положительным давлением и другие поддерживающие меры продлевают выживаемость пациентов с МДД [6], которые сообщают об удивительно высоком качестве жизни в областях, напрямую не связанных с их физическими нарушениями. [6]
С возрастом пациенты с МДД могут страдать от проблем с питанием из-за нарушения глотания, скопления желудочного воздуха, желудочно-пищеводного рефлюкса и хронических запоров, которые могут привести к опасным для жизни осложнениям. [7] Однако это не подвергалось систематической оценке в научных исследованиях, и имеется мало научной информации о возможных механизмах и лечении этих состояний у пациентов с МДД.[8–12] На моделях мышей, однако, изменения мышечно-кишечного сплетения, связанные со снижением миоэлектрической медленноволновой активности [13, 14] наряду с уменьшением доступности NO [15, 16] из-за отсутствия дистрофина, действующего как якорь для NO-синтаза участвует в нарушении моторики ЖКТ.
Целью данного исследования является оценка типа и распространенности субъективных и объективных желудочно-кишечных расстройств у пациентов с МДД. Мы предположили, что желудочно-кишечный транспорт у пациентов с МДД был задержан по сравнению с референсными значениями, указанными для здоровых субъектов.
Методы
Пациенты
Было предложено принять участие пациентов мужского пола с МДД, посещающих амбулаторную клинику легочного отделения и нервно-мышечного центра университетской больницы Цюриха. Критерии включения: диагноз МДД на основании генетических и / или типичных клинических данных, включая мышечную биопсию, возраст старше 7 лет и стабильное состояние в течение последних 3 месяцев. Критериями исключения были: острая инфекция или дыхательная недостаточность, острые нарушения моторики желудочно-кишечного тракта, такие как синдром Огилви, и хирургическое вмешательство в последние 3 месяца.Мы включили 33 пациента, из которых 26 проживали в учреждении долгосрочного ухода Mathilde Escher Heim, а 7 пациентов жили со своими семьями в частных домах. Пациенты получают ультрасовременную долгосрочную помощь [17, 18], включающую регулярные последующие обследования и лечение скелетно-мышечных, респираторных, сердечных, желудочно-кишечных и других проблем, если это необходимо. Пациенты должны были находиться в стабильных условиях в течение последних трех месяцев.
Пациенты получают ультрасовременную долгосрочную помощь [17, 18], включающую регулярные последующие обследования и лечение скелетно-мышечных, респираторных, сердечных, желудочно-кишечных и других проблем, если это необходимо. Пациенты должны были находиться в стабильных условиях в течение последних трех месяцев.
Информированное согласие было получено от всех участников.Если участник физически не мог документально подтвердить свое согласие в письменной форме, лицо, осуществляющее уход, и директор медсестер документировали устное информированное согласие. От участников моложе 18 лет дополнительно требовалось, чтобы хотя бы один из родителей мог подписать информированное согласие. Исследование было одобрено институциональным этическим комитетом (Kantonale Ethikkommission Zürich; KEK-ZH-Nr. 2010–0289).
Клиническая и анкетная оценка
Оценка включала в себя анамнез, анкеты о физических нарушениях, приеме пищи и жидкости, функции желудочно-кишечного тракта и физикальном обследовании. Физические нарушения и зависимость от медицинской помощи оценивались по шкале «Нарушение мышечной дистрофии Дюшенна и зависимость от медицинской помощи» (оценка DID) [6], которая оценивает восемь областей повседневной жизни, каждая из которых оценивается по шкале от 1 (в одной области 2) до 10 баллов. с возрастающей зависимостью. Общий балл DID, равный 9, означает отсутствие нарушений; оценка 80 означает полное нарушение здоровья и зависимость от медицинской помощи. Оценка рассчитывается на основе функционального статуса по восьми различным аспектам (подвижность с техническими средствами и без них, перемещение, статический контроль тела, изменение положения тела, одевание, прием пищи, питье и дыхание).Мы оценили возраст как непрерывную и бинарную переменную и определили «пожилых пациентов» как людей старше 21 года.
Физические нарушения и зависимость от медицинской помощи оценивались по шкале «Нарушение мышечной дистрофии Дюшенна и зависимость от медицинской помощи» (оценка DID) [6], которая оценивает восемь областей повседневной жизни, каждая из которых оценивается по шкале от 1 (в одной области 2) до 10 баллов. с возрастающей зависимостью. Общий балл DID, равный 9, означает отсутствие нарушений; оценка 80 означает полное нарушение здоровья и зависимость от медицинской помощи. Оценка рассчитывается на основе функционального статуса по восьми различным аспектам (подвижность с техническими средствами и без них, перемещение, статический контроль тела, изменение положения тела, одевание, прием пищи, питье и дыхание).Мы оценили возраст как непрерывную и бинарную переменную и определили «пожилых пациентов» как людей старше 21 года.
Пациенты сообщили о своем типе и количестве потребляемой пищи и жидкости, а также о энтеральном питании через чрескожную энтеростомическую трубку, а также о количестве и качестве испражнений [19] в течение трех недель подряд.
Диспепсия оценивалась с помощью краткого опросника по диспепсии Лидса (SF-LDQ), который оценивает расстройство желудка, изжогу, срыгивание и тошноту по шкале от 0 до 4 с возрастающей частотой и вмешательством в повседневную жизнь, а также задается вопрос о наиболее распространенном симптоме. также включены.Оценка 7 из 32 баллов считается показателем диспепсии. [20] Задержка опорожнения желудка (GE) оценивалась с помощью индекса кардинальных симптомов гастропареза (GCSI), оценивающего девять симптомов (переполнение желудка, потеря аппетита, неспособность закончить прием пищи, чрезмерное наполнение желудка после еды, вздутие живота, субъективно увеличенный желудок, тошнота, рвота и рвота) каждая оценивается от 0 до 5. Гастропарез считается присутствующим с оценкой> 18 из 32 баллов [21]. Симптомы нижних отделов желудочно-кишечного тракта и запор оценивались по Римским критериям III для функционального запора, включая ответы на 17 вопросов о дискомфорте в животе, боли, частоте и качестве дефекации, качестве стула и продолжительности симптомов. Затем было решено наличие или отсутствие функционального запора на основании критериев Рима III для запора (натуживание во время дефекации, комковатый или твердый стул, ощущение неполной дефекации, ощущение непроходимости, использование ручных маневров для облегчения дефекации, менее трех дефекаций в неделю , отсутствие жидкого стула без использования слабительных и отсутствие критериев синдрома раздраженного кишечника) [22].
Затем было решено наличие или отсутствие функционального запора на основании критериев Рима III для запора (натуживание во время дефекации, комковатый или твердый стул, ощущение неполной дефекации, ощущение непроходимости, использование ручных маневров для облегчения дефекации, менее трех дефекаций в неделю , отсутствие жидкого стула без использования слабительных и отсутствие критериев синдрома раздраженного кишечника) [22].
Измерения транзита через желудок и кишечник
Желудочный и кишечный транзит оценивался с помощью общепринятых тестов, основанных на мониторинге 13 CO 2 концентрации в выдыхаемом воздухе после приема маркированной пищи.Транзит толстой кишки оценивали с помощью рентгенографии брюшной полости, выполненной после приема рентгеноконтрастных маркеров.
Таким образом, опорожнение желудка и прохождение через рото-слепой кишку оценивали путем измерения изменения концентрации 13 CO 2 в выдыхаемом воздухе после приема стандартизированного пробного завтрака, меченного (нерадиоактивным) изотопом 13 C. Все участники оставались голодными, и им было предложено воздержаться от курения в течение ночи до оценки опорожнения желудка и прохождения орально-слепой кишки.Для оценки опорожнения желудка пробный завтрак, состоящий из 60 г яичницы-болтуньи, смешанной с 100 мг 13 C-октаноата натрия (Euriso-Top, Saint-Aubin Cedex, Франция) на 60 г белого хлеба и 1 г вводили сливочное масло (240 ккал, 1005 кДж). [23, 24] Кишечный транспорт оценивался путем измерения времени прохождения через рото-слепой канал (OCTT) с использованием лактозы 13 C-уреид (Euriso-Top, Saint-Aubin Cedex, France ) в качестве индикатора после стандартизированного прайминга кишечной флоры 1 г немеченого уреида лактозы в день в течение 5 дней.[25–27] Пробный завтрак был идентичен тому, который подавали для опорожнения желудка, но вместо добавления в яйцо 13 C-октаноата натрия в масло добавляли 100 мг лактозы 13 C-уреида.
Все участники оставались голодными, и им было предложено воздержаться от курения в течение ночи до оценки опорожнения желудка и прохождения орально-слепой кишки.Для оценки опорожнения желудка пробный завтрак, состоящий из 60 г яичницы-болтуньи, смешанной с 100 мг 13 C-октаноата натрия (Euriso-Top, Saint-Aubin Cedex, Франция) на 60 г белого хлеба и 1 г вводили сливочное масло (240 ккал, 1005 кДж). [23, 24] Кишечный транспорт оценивался путем измерения времени прохождения через рото-слепой канал (OCTT) с использованием лактозы 13 C-уреид (Euriso-Top, Saint-Aubin Cedex, France ) в качестве индикатора после стандартизированного прайминга кишечной флоры 1 г немеченого уреида лактозы в день в течение 5 дней.[25–27] Пробный завтрак был идентичен тому, который подавали для опорожнения желудка, но вместо добавления в яйцо 13 C-октаноата натрия в масло добавляли 100 мг лактозы 13 C-уреида.
После приема тестовой еды пробы выдыхаемого воздуха отбирались каждые 15 минут в течение 8 часов для опорожнения желудка, а также для OCTT, а затем каждые 30 минут до 12 часов только для OCTT. Временной интервал между тестами составлял в среднем (межквартильный размах) 33 (10, 52) дня, минимум 1 день у двух испытуемых.У пациентов со спонтанным дыханием образцы выдыхаемого воздуха отбирались путем их выдоха в пластиковый пакет после полного вдоха. У пациентов на вспомогательной вентиляции пробы выдыхаемого воздуха отбирались через боковой порт трахеостомы. Анализ образцов проводился с помощью недисперсионной изотопно-селективной инфракрасной спектроскопии (NDIRS, IRIS, Wagner Analysen Technik, Германия). [28, 29] Коэффициент опорожнения желудка (GEC), время задержки опорожнения желудка (T lag ; время до максимума 13 CO 2 экскреция) и полупериод (T 1/2 ; время, необходимое для выведения 50% дозы 13 C) были рассчитаны с использованием модели нелинейной регрессии 13 Восстановление C в выдыхаемом воздухе согласно Ghoos et al.[23]. На рис. 1 представлена концепция времени задержки и полупериода опорожнения желудка.
Временной интервал между тестами составлял в среднем (межквартильный размах) 33 (10, 52) дня, минимум 1 день у двух испытуемых.У пациентов со спонтанным дыханием образцы выдыхаемого воздуха отбирались путем их выдоха в пластиковый пакет после полного вдоха. У пациентов на вспомогательной вентиляции пробы выдыхаемого воздуха отбирались через боковой порт трахеостомы. Анализ образцов проводился с помощью недисперсионной изотопно-селективной инфракрасной спектроскопии (NDIRS, IRIS, Wagner Analysen Technik, Германия). [28, 29] Коэффициент опорожнения желудка (GEC), время задержки опорожнения желудка (T lag ; время до максимума 13 CO 2 экскреция) и полупериод (T 1/2 ; время, необходимое для выведения 50% дозы 13 C) были рассчитаны с использованием модели нелинейной регрессии 13 Восстановление C в выдыхаемом воздухе согласно Ghoos et al.[23]. На рис. 1 представлена концепция времени задержки и полупериода опорожнения желудка. OCTT определяли путем регистрации более чем 2 изменения обогащения 13 C по сравнению с исходным уровнем в выдыхаемом воздухе (дельта по сравнению с исходным уровнем, DOB> 2 ‰), как описано Wutzke et al. [30] Результаты измерений желудочно-кишечного транзита сравнивались со следующими значениями, наблюдаемыми в нормальном контроле (среднее ± стандартное отклонение): время задержки опорожнения желудка 70,1 ± 10,2 минуты, [31] полупериод опорожнения желудка 107,3 ± 9,9 минут, [31] коэффициент опорожнения желудка 3 ± 0.4 [31] и время прохождения через рототечную кишку 3,0 ± 1,4 часа [25]. Отклонение более чем на 1SD от среднего было определено как ненормальное.
OCTT определяли путем регистрации более чем 2 изменения обогащения 13 C по сравнению с исходным уровнем в выдыхаемом воздухе (дельта по сравнению с исходным уровнем, DOB> 2 ‰), как описано Wutzke et al. [30] Результаты измерений желудочно-кишечного транзита сравнивались со следующими значениями, наблюдаемыми в нормальном контроле (среднее ± стандартное отклонение): время задержки опорожнения желудка 70,1 ± 10,2 минуты, [31] полупериод опорожнения желудка 107,3 ± 9,9 минут, [31] коэффициент опорожнения желудка 3 ± 0.4 [31] и время прохождения через рототечную кишку 3,0 ± 1,4 часа [25]. Отклонение более чем на 1SD от среднего было определено как ненормальное.
Рис. 1. Иллюстрация анализа и типичные временные точки опорожнения желудка.
Время задержки (задержка T ; время до максимальной экскреции 13 CO 2 ) и полупериод (T 1/2 ; время, необходимое для выведения 50% дозы 13 C ) Дата рождения: Дельта выше базовой линии (в процентах от 13 CO 2 восстановленных). cPDR: совокупная восстановленная процентная доза.
cPDR: совокупная восстановленная процентная доза.
https://doi.org/10.1371/journal.pone.0163779.g001
Время прохождения через толстую кишку (CTT) было измерено после проглатывания капсулы (P. & A. Mauch, Münchenstein, Швейцария), каждая из которых содержала 10 рентгеноконтрастных маркеров, ежедневно в течение шести дней подряд. На седьмой день сделана рентгенограмма брюшной полости. CTT рассчитывали в часах как сумму удерживаемых маркеров, умноженную на 2,4 (с учетом введения 10 маркеров за 24 часа).[32] CTT более 60 часов у мужчин независимо от статуса курения, 66 часов у курильщиков и 44 часа у никогда не куривших (90 -й процентиль) считается отсроченным. [33]
Статистический анализ
Данные представлены как медианы (межквартильный размах) и средние значения (СО) для ненормально и нормально распределенных данных соответственно. Корреляции рассчитывались с использованием критерия ранговой корреляции Спирмена. Множественная логистическая регрессия использовалась для оценки связи возраста, степени физических нарушений, вентиляции с положительным давлением и приема лекарств с желудочно-кишечным транзитом. Статистический анализ был запрограммирован в SAS 9.3 (SAS Institute Inc., Кэри, Северная Каролина, США). Вероятность p <0,05 считалась достоверной.
Статистический анализ был запрограммирован в SAS 9.3 (SAS Institute Inc., Кэри, Северная Каролина, США). Вероятность p <0,05 считалась достоверной.
Результаты
Характеристики пациентов и оценка анкеты
Обследовано 33 пациента со средним возрастом 24 года (от 12 до 41 года). Большинство из них страдали тяжелыми физическими недостатками и зависели от инвалидной коляски, что отражено в среднем балле по шкале Дюшенна 56,7. Двадцати трем участникам (70%) потребовалась ИВЛ; из этих девяти (27% от всех пациентов) искусственная вентиляция легких проводилась 24 часа в сутки.Двадцать один участник (64%) регулярно принимал слабительные или прокинетические препараты.
Модуль запора Rome III показал положительный результат на запор у 23 участников (70%). Средний балл SF-LDQ составил 3,73 (диапазон от 0 до 10; 7 участников имели балл ≥7, указывающий на диспепсию) [20]. Средний балл по шкале GCSI составлял 9 (диапазон от 0 до 25, при этом 5 участников имели балл> 18, что указывает на окончательный гастропарез). Основными жалобами, оцененными GCSI, были неспособность закончить нормальный прием пищи, чувство сытости после приема пищи и вздутие живота (средний балл по пункту 1.9, 1,7 и 1,7 соответственно; Таблица 1) [21, 34] Основные данные для всех представленных результатов можно найти в таблице S1.
Основными жалобами, оцененными GCSI, были неспособность закончить нормальный прием пищи, чувство сытости после приема пищи и вздутие живота (средний балл по пункту 1.9, 1,7 и 1,7 соответственно; Таблица 1) [21, 34] Основные данные для всех представленных результатов можно найти в таблице S1.
Меры желудочно-кишечного транзита
Объективные меры.
Один пациент не мог быть обследован с помощью метода 13 C из-за интеркуррентной инфекции, требующей антибиотиков. Трем пациентам не удалось оценить КТТ из-за невозможности проглотить рентгеноконтрастные маркеры.
Опорожнение желудка задерживалось, как количественно выражено с помощью медианы (межквартильные диапазоны) времени задержки опорожнения желудка (T , отставание ) и полупериода (T 1/2 ) 134 (109, 164) и 187 (186, 220). ) минут соответственно.Таким образом, все участники имели продолжительные значения выше верхнего предела нормы (ULN; 80 минут и 117 минут соответственно), как определено выше на основе ранее опубликованных данных о здоровых людях [31]. Не было статистически значимой разницы между участниками, у которых не было вентиляции с положительным давлением (PPV; n = 10) с TT 1/2 на 201 (182, 230) минуту, и участниками, которым требовалась PPV (n = 23). ) с T 1/2 183 (131, 211) минут (p = 0,2; рис. 2). Соответственно, коэффициенты опорожнения желудка были низкими, в среднем 2.9 (2,4, 2,9), по сравнению с нижней границей нормы (LLN: 2,6) [31] (Таблица 2).
Не было статистически значимой разницы между участниками, у которых не было вентиляции с положительным давлением (PPV; n = 10) с TT 1/2 на 201 (182, 230) минуту, и участниками, которым требовалась PPV (n = 23). ) с T 1/2 183 (131, 211) минут (p = 0,2; рис. 2). Соответственно, коэффициенты опорожнения желудка были низкими, в среднем 2.9 (2,4, 2,9), по сравнению с нижней границей нормы (LLN: 2,6) [31] (Таблица 2).
Рис. 2. Анализ выдыхаемого воздуха для оценки опорожнения желудка у 32 пациентов.
Среднее изменение (IQR) по сравнению с исходным уровнем 13 Обогащение C (дельта по сравнению с исходным уровнем, DOB) в выдыхаемом воздухе после проглатывания пробного завтрака показано вместе с кумулятивным процентным восстановлением дозы (cPDR). Вертикальные пунктирные линии (пациенты, принимающие PPV: длинная пунктирная вертикальная линия через 183 минуты; пациенты со спонтанным дыханием: короткая пунктирная вертикальная линия через 201 минуту) показывают среднее время восстановления 50% кумулятивной дозы. Это было значительно больше, чем полупериод обычного контроля (сплошная вертикальная линия на 107 минутах). [31]
Это было значительно больше, чем полупериод обычного контроля (сплошная вертикальная линия на 107 минутах). [31]
https://doi.org/10.1371/journal.pone.0163779.g002
Время прохождения оро-слепой кишки (OCTT) было увеличено на 6,3 (5,0, 7,9) часа по сравнению с ранее опубликованными данными (ULN: 4,4 часы). [25] Не было статистически значимой разницы между участниками, у которых не было PPV с OCTT 6,2 (5,5, 7,8) часа, и участниками, которым требовалась PPV с OCTT 6.3 (4,9; 8,0) часа (p = 0,5; рис. 3).
Рис. 3. Ороцекальный транзит, оцененный анализом выдыхаемого воздуха у 33 пациентов.
Показаны изменения медианы (IQR) по сравнению с исходным уровнем изотопного обогащения в выдыхаемом воздухе, генерируемого пробной едой, обогащенной 13C. Среднее время прохождения через рото-слепой канал было одинаковым у пациентов со спонтанным дыханием (370 минут; без вентиляции с положительным давлением; без PPV)) и с механической вентиляцией (378 минут; с вентиляцией с положительным давлением; с PPV) и значительно дольше, чем у здоровых контрольных пациентов (сплошная вертикальная линия). линия на 295 минутах).[25]
линия на 295 минутах).[25]
https://doi.org/10.1371/journal.pone.0163779.g003
Время прохождения через толстую кишку (CTT) также было довольно долгим, медиана (межквартильный размах) 60 (49, 82) часов, несмотря на использование слабительного и прокинетические меры у 21 из 32 пациентов. Шестнадцать из 30 пациентов, которым была проведена оценка CTT (54%), и 21 из 27 (78%) некурящих пациентов имели повышенный CTT выше 90 -го процентиля. У четырнадцати из 30 участников (47%) было ректальное накопление рентгеноконтрастных маркеров, указывающих на обструкцию выходного отверстия таза, в то время как у остальных был более диффузный характер распределения маркеров, указывающий на запор медленного транзита.Типичный пример рентгенограммы брюшной полости с маркерами показан на рис. 4.
Рис. 4. Репрезентативная рентгенограмма брюшной полости.
Это типичный рентгеновский снимок 38-летнего пациента с мышечной дистрофией Дюшенна, не находящегося в острой форме. В толстой кишке видны рентгеноконтрастные маркеры и обширный метеоризм. Видны стержни и винты (один из них смещен) для стабилизации позвоночника и трубка ПЭГ.
В толстой кишке видны рентгеноконтрастные маркеры и обширный метеоризм. Видны стержни и винты (один из них смещен) для стабилизации позвоночника и трубка ПЭГ.
https://doi.org/10.1371/journal.pone.0163779.g004
Клиническая характеристика и желудочно-кишечный транзит.
Чтобы оценить связь между клиническими характеристиками и показателями желудочно-кишечного транзита с возрастом и более выраженными физическими нарушениями, был проведен исследовательский корреляционный анализ Спирмена. Они выявили значительную связь более высоких показателей DID с критериями Рима III для оценки запора, а также с индексом основных симптомов гастропареза (GCSI). Более слабые пациенты также значительно чаще использовали прокинетические или слабительные препараты.Аналогичные результаты были получены для пожилых пациентов (таблица 3).
Хотя лаг T , а также T 1/2 были схожими у пациентов старше 21 года по сравнению с более молодыми пациентами (таблица 3), они были значительно короче у пожилых пациентов, когда возраст использовался в качестве непрерывной переменной (коэффициент -0,38, p = 0,03 и коэффициент -0,37, p = 0,04 соответственно). Для дальнейшей оценки этого вывода и контроля мешающих факторов была проведена множественная регрессия. Это подтвердило значительную обратную взаимосвязь между старшим возрастом и лагом T и T 1/2 с поправкой на использование слабительных и прокинетических препаратов, а также вентиляцию с положительным давлением (коэффициент -35.4, p = 0,02 и коэффициент -56,5, p = 0,01 соответственно). Поправка на вентиляцию с положительным давлением и использование прокинетических и слабительных препаратов также подтвердила значительную связь между оценкой DID и GCSI (коэффициент 0,21, p = 0,048). Тот же анализ, проведенный только для пациентов, находящихся на ИВЛ, показал еще более сильную связь (коэффициент 0,54, p = 0,0002).
Для дальнейшей оценки этого вывода и контроля мешающих факторов была проведена множественная регрессия. Это подтвердило значительную обратную взаимосвязь между старшим возрастом и лагом T и T 1/2 с поправкой на использование слабительных и прокинетических препаратов, а также вентиляцию с положительным давлением (коэффициент -35.4, p = 0,02 и коэффициент -56,5, p = 0,01 соответственно). Поправка на вентиляцию с положительным давлением и использование прокинетических и слабительных препаратов также подтвердила значительную связь между оценкой DID и GCSI (коэффициент 0,21, p = 0,048). Тот же анализ, проведенный только для пациентов, находящихся на ИВЛ, показал еще более сильную связь (коэффициент 0,54, p = 0,0002).
Симптомы и объективные показатели желудочно-кишечного транзита.
Далее мы оценили, коррелировали ли субъективные симптомы с объективными показателями желудочно-кишечного транспорта.Мы обнаружили, что опорожнение желудка и время прохождения через рото-слепую кишку не были достоверно связаны с симптомами, измеренными субъективным GCSI или SF-LDQ (Таблица 3).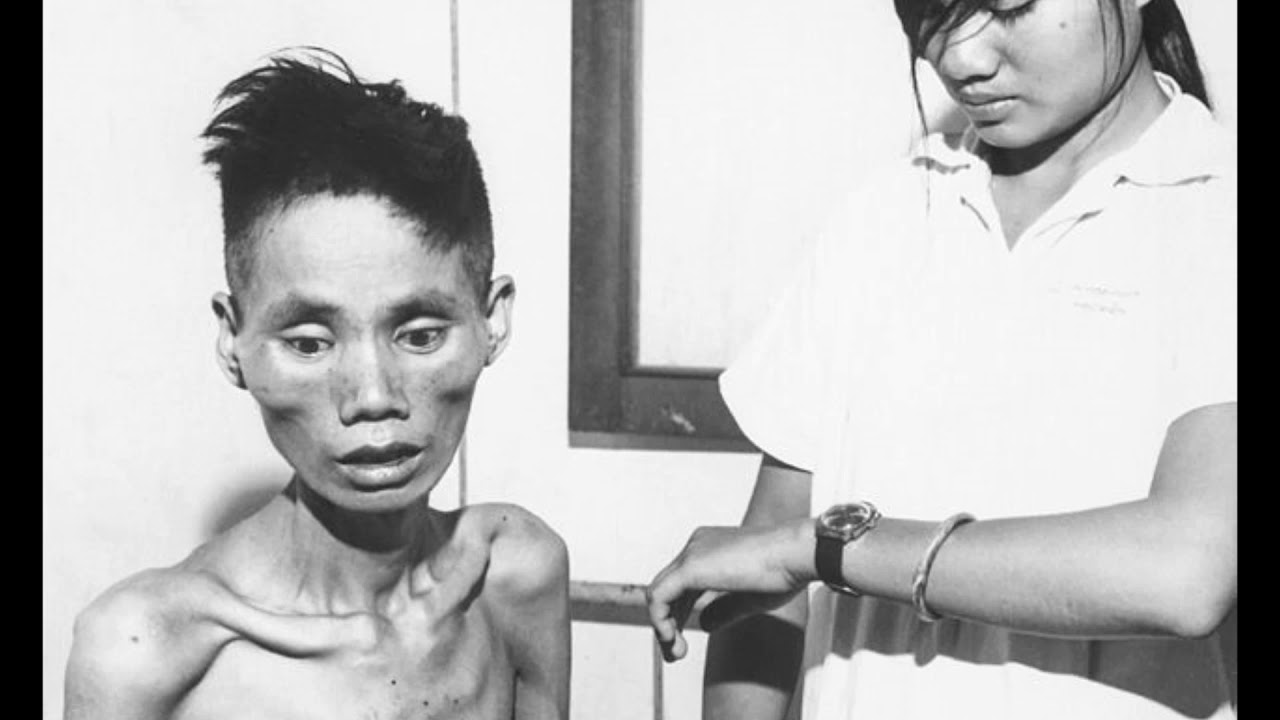 Единственное исключение – ассоциация T lag с SF-LDQ. Однако множественный регрессионный анализ, контролирующий использование прокинетических и слабительных показателей и оценку DID или возраст, не выявил каких-либо значимых связей между отставанием T и SF-LDQ или любыми другими из вышеупомянутых объективных показателей желудочно-кишечного транспорта и субъективными отчетами. (все p> 0.05). Более того, транзит через толстую кишку не был в значительной степени связан с симптомами, измеряемыми критериями Рима III (ни в корреляционном анализе Спирмена, коэффициент 0,12, p = 0,5, ни в анализе множественной регрессии, учитывающем использование прокинетических и слабительных мер, а также оценку DID или возраст. ).
Единственное исключение – ассоциация T lag с SF-LDQ. Однако множественный регрессионный анализ, контролирующий использование прокинетических и слабительных показателей и оценку DID или возраст, не выявил каких-либо значимых связей между отставанием T и SF-LDQ или любыми другими из вышеупомянутых объективных показателей желудочно-кишечного транспорта и субъективными отчетами. (все p> 0.05). Более того, транзит через толстую кишку не был в значительной степени связан с симптомами, измеряемыми критериями Рима III (ни в корреляционном анализе Спирмена, коэффициент 0,12, p = 0,5, ни в анализе множественной регрессии, учитывающем использование прокинетических и слабительных мер, а также оценку DID или возраст. ).
Обсуждение
Настоящее исследование является первой всесторонней количественной оценкой желудочно-кишечного транзита на всем его протяжении у пациентов с мышечной дистрофией Дюшенна.Прогрессирующее заболевание было связано с нарушением глотания, скоплением кишечного воздуха и хроническим запором (рис. 4), что до сих пор не получило должной оценки в научных исследованиях [17, 18]. Важно отметить, что мы обнаружили, что симптомы нарушения функции желудочно-кишечного тракта не были значительными. коррелирует с объективными показателями нарушения желудочно-кишечного транспорта, что позволяет предположить, что пациенты могут не ощущать потенциально опасный запор, требующий терапевтических мер. Нарушение функции желудочно-кишечного тракта может еще больше усложнить уход за пожилыми пациентами с МДД, которые уже страдают прогрессирующими нарушениями из-за общей потери мышечной силы, дыхательной и сердечной недостаточности.
4), что до сих пор не получило должной оценки в научных исследованиях [17, 18]. Важно отметить, что мы обнаружили, что симптомы нарушения функции желудочно-кишечного тракта не были значительными. коррелирует с объективными показателями нарушения желудочно-кишечного транспорта, что позволяет предположить, что пациенты могут не ощущать потенциально опасный запор, требующий терапевтических мер. Нарушение функции желудочно-кишечного тракта может еще больше усложнить уход за пожилыми пациентами с МДД, которые уже страдают прогрессирующими нарушениями из-за общей потери мышечной силы, дыхательной и сердечной недостаточности.
Время задержки опорожнения желудка (T , отставание ) и полупериод (T 1/2 ) были значительно увеличены по сравнению со здоровыми добровольцами, измеренными нами с использованием идентичного пробного завтрака с маркировкой 13 C, а также в вся остальная оцененная литература. [31, 35–38] Также время прохождения через рото-кишечный тракт (OCTT) было значительно дольше, чем в ранее опубликованных данных для здоровых субъектов. [25] Не было существенной разницы между пациентами со спонтанным дыханием и пациентами, принимающими PPV, ни по одному из объективных показателей желудочно-кишечного транзита.Наши результаты также показывают, что время прохождения через рото-слепой канал (OCTT) у пациентов с Дюшенном на самом деле задерживается, в отличие от более ранних исследований, в которых большие количества немаркированной лактулозы (Duphalac ® ) в воде использовались для оценки времени прохождения через рототечную кишку [12]. ] Мы дополнительно показали, что время прохождения через толстую кишку (CTT) было увеличено, несмотря на широкое применение слабительных средств. [33] У 47% пациентов распределение рентгеноконтрастных маркеров в толстой кишке сохранялось в ректосигмоиде, что указывало на обструкцию выходного отверстия таза как дополнительную проблему.Эти результаты подтверждают и расширяют более ранние исследования транзита через толстую кишку у детей с МДД [8]. Только 12 из наших участников не использовали слабительные, прокинетические препараты или клизмы, а 9 из 33 получали чрескожное энтеральное питание.
[25] Не было существенной разницы между пациентами со спонтанным дыханием и пациентами, принимающими PPV, ни по одному из объективных показателей желудочно-кишечного транзита.Наши результаты также показывают, что время прохождения через рото-слепой канал (OCTT) у пациентов с Дюшенном на самом деле задерживается, в отличие от более ранних исследований, в которых большие количества немаркированной лактулозы (Duphalac ® ) в воде использовались для оценки времени прохождения через рототечную кишку [12]. ] Мы дополнительно показали, что время прохождения через толстую кишку (CTT) было увеличено, несмотря на широкое применение слабительных средств. [33] У 47% пациентов распределение рентгеноконтрастных маркеров в толстой кишке сохранялось в ректосигмоиде, что указывало на обструкцию выходного отверстия таза как дополнительную проблему.Эти результаты подтверждают и расширяют более ранние исследования транзита через толстую кишку у детей с МДД [8]. Только 12 из наших участников не использовали слабительные, прокинетические препараты или клизмы, а 9 из 33 получали чрескожное энтеральное питание. Такие различия в уходе за пациентами могли в некоторой степени спутать текущие результаты с потенциальной недооценкой нарушенного желудочно-кишечного транспорта, что не могло быть полностью объяснено с помощью множественного регрессионного анализа.
Такие различия в уходе за пациентами могли в некоторой степени спутать текущие результаты с потенциальной недооценкой нарушенного желудочно-кишечного транспорта, что не могло быть полностью объяснено с помощью множественного регрессионного анализа.
В качестве возможного механизма текущих результатов мы предполагаем, что, помимо снижения способности произвольно напрягаться, снижение миоэлектрической медленноволновой активности наряду со сниженной доступностью кишечного NO, как показано на моделях мышей, может быть ответственным за измеренное увеличение желудочно-кишечного транзита. время.[13–16] Ампулярная предрасположенность распределения маркеров толстой кишки может быть связана с неспособностью повысить внутрибрюшное давление и неадекватным принятием правильной позы для выпрямления аноректального угла. [39]
В нашей исследуемой популяции наблюдалась значительная обратная корреляция между Т опорожнения желудка, отставанием , а также Т 1/2 и старшим возрастом в нескорректированной модели, а также после корректировки на вентиляцию с положительным давлением и использования прокинетических и слабительных препаратов. .Это можно объяснить более регулярным и активным использованием прокинетических и слабительных препаратов и, возможно, более регулярным приемом пищи и жидкости в условиях ухода за больными с более прогрессирующими стадиями заболевания. Несмотря на поправку в многомерной модели для вентиляции с положительным давлением, небольшое уменьшение продолжительного опорожнения желудка T , задержка , T 1/2 и OCTT также могло быть связано с предполагаемым, хотя и недоказанным побочным эффектом увеличения времени вентиляции у пациентов с прогрессирующее заболевание.Однако более высокие баллы DID также были связаны с более высокими баллами GCSI в многомерной модели, включая использование прокинетических и слабительных препаратов и вентиляцию с положительным давлением. Повышенные показатели симптомов по шкале GCSI были связаны с более высокими показателями DID в анализе, ограниченном только пациентами, находящимися на ИВЛ.
.Это можно объяснить более регулярным и активным использованием прокинетических и слабительных препаратов и, возможно, более регулярным приемом пищи и жидкости в условиях ухода за больными с более прогрессирующими стадиями заболевания. Несмотря на поправку в многомерной модели для вентиляции с положительным давлением, небольшое уменьшение продолжительного опорожнения желудка T , задержка , T 1/2 и OCTT также могло быть связано с предполагаемым, хотя и недоказанным побочным эффектом увеличения времени вентиляции у пациентов с прогрессирующее заболевание.Однако более высокие баллы DID также были связаны с более высокими баллами GCSI в многомерной модели, включая использование прокинетических и слабительных препаратов и вентиляцию с положительным давлением. Повышенные показатели симптомов по шкале GCSI были связаны с более высокими показателями DID в анализе, ограниченном только пациентами, находящимися на ИВЛ.
Как мы показали ранее [7], у пациентов с Дюшенном существует значительный риск развития опасного для жизни запора в сочетании с метаболическим ацидозом, когда прогрессирующие трудности с глотанием приводят к недостаточному потреблению жидкости и калорий и к дальнейшему нарушению моторики желудочно-кишечного тракта. Следовательно, в текущем исследовании не было возможности прекратить регулярное лечение пациента. Также не существует контрольной группы пациентов мужского пола на ИВЛ, неподвижных и соответствующего возраста, не страдающих мышечной дистрофией. Потенциальными ограничениями в нашем исследовании были трудности, с которыми пациенты сталкивались при своевременном пережевывании и проглатывании пробной еды. Тем не менее, мы смогли показать значительное удлинение T 1/2 , OCTT, а также CTT у пациентов с мышечной дистрофией Дюшенна по сравнению с нормальными данными, полученными из литературы.Без слабительного лечения у любого из этих пациентов результаты могут быть еще более впечатляющими. Это особенно важно с клинической точки зрения, поскольку наши результаты показывают, что симптомы не могут предсказать потенциально опасный запор. Отсутствие значимой корреляции между симптомами и объективными показателями нарушения желудочно-кишечного транспорта может быть связано с сенсорными нарушениями из-за экспрессии изоформы дистрофина DP116 в периферической нервной ткани [40] и аутосомных гомологов DP116 в сенсорных ганглиях.
Следовательно, в текущем исследовании не было возможности прекратить регулярное лечение пациента. Также не существует контрольной группы пациентов мужского пола на ИВЛ, неподвижных и соответствующего возраста, не страдающих мышечной дистрофией. Потенциальными ограничениями в нашем исследовании были трудности, с которыми пациенты сталкивались при своевременном пережевывании и проглатывании пробной еды. Тем не менее, мы смогли показать значительное удлинение T 1/2 , OCTT, а также CTT у пациентов с мышечной дистрофией Дюшенна по сравнению с нормальными данными, полученными из литературы.Без слабительного лечения у любого из этих пациентов результаты могут быть еще более впечатляющими. Это особенно важно с клинической точки зрения, поскольку наши результаты показывают, что симптомы не могут предсказать потенциально опасный запор. Отсутствие значимой корреляции между симптомами и объективными показателями нарушения желудочно-кишечного транспорта может быть связано с сенсорными нарушениями из-за экспрессии изоформы дистрофина DP116 в периферической нервной ткани [40] и аутосомных гомологов DP116 в сенсорных ганглиях. [41] Кроме того, некоторые пациенты с МДД могут занижать сведения о желудочно-кишечных симптомах, страдающих от различных тяжелых симптомов, включая неподвижность и недостаточное дыхание, что может вызывать большее беспокойство.
[41] Кроме того, некоторые пациенты с МДД могут занижать сведения о желудочно-кишечных симптомах, страдающих от различных тяжелых симптомов, включая неподвижность и недостаточное дыхание, что может вызывать большее беспокойство.
Таким образом, наши результаты впервые предоставляют всестороннюю количественную оценку желудочно-кишечного транспорта у пациентов с МДД в широком возрастном диапазоне с использованием как объективных измерений, так и зарегистрированных симптомов. В то время как более ранние исследования были сосредоточены на конкретных аспектах перистальтики кишечника, таких как опорожнение желудка [9, 10, 12] или транзит через толстую кишку в небольших группах детей с МДД, текущее исследование распространяет эти наблюдения на подростков и взрослых пациентов с МДД.Эти новые данные, показывающие нарушение функции желудочно-кишечного тракта, но отсутствие связи между симптомами и объективными оценками, имеют клиническое значение, поскольку они могут помочь улучшить лечение пациентов с МДД, выделив нарушение желудочно-кишечного транзита как терапевтическую цель, которая может предотвратить опасные для жизни осложнения. . [7] Эти аспекты становятся еще более важными с увеличением продолжительности жизни пациентов с МДД.
. [7] Эти аспекты становятся еще более важными с увеличением продолжительности жизни пациентов с МДД.
Дополнительная информация
S1 Таблица.Результаты по предметам исследования.
Данные, использованные для анализа, отсортированы по номерам субъектов исследования. Оценка DID: оценка мышечной дистрофии Дюшенна и зависимости от лечения; ПЭГ: использование чрескожной эндоскопической гастростомии для кормления; tlag: время задержки опорожнения желудка в минутах; thalf: половина времени опорожнения желудка в минутах; gec: коэффициент опорожнения желудка; OCTT: время прохождения орально-слепой кишки, часы; Время прохождения CTT по толстой кишке, час; Вентиляция: Вентиляционная поддержка кодируется следующим образом: 0 = нет вентиляции, 1 = вентиляционная поддержка только в ночное время (неинвазивная), 2 = вентиляционная поддержка в течение 24 часов в сутки (неинвазивная), 3 = постоянная вентиляционная поддержка посредством трахеостомии; запор = двоичный результат для запора, основанный на критериях Рима III для запора и отсутствии критериев синдрома раздраженного кишечника; SF-LDQ: Краткий опросник Лидса о диспепсии; GCSI: Индекс кардинальных симптомов гастропареза
https: // doi.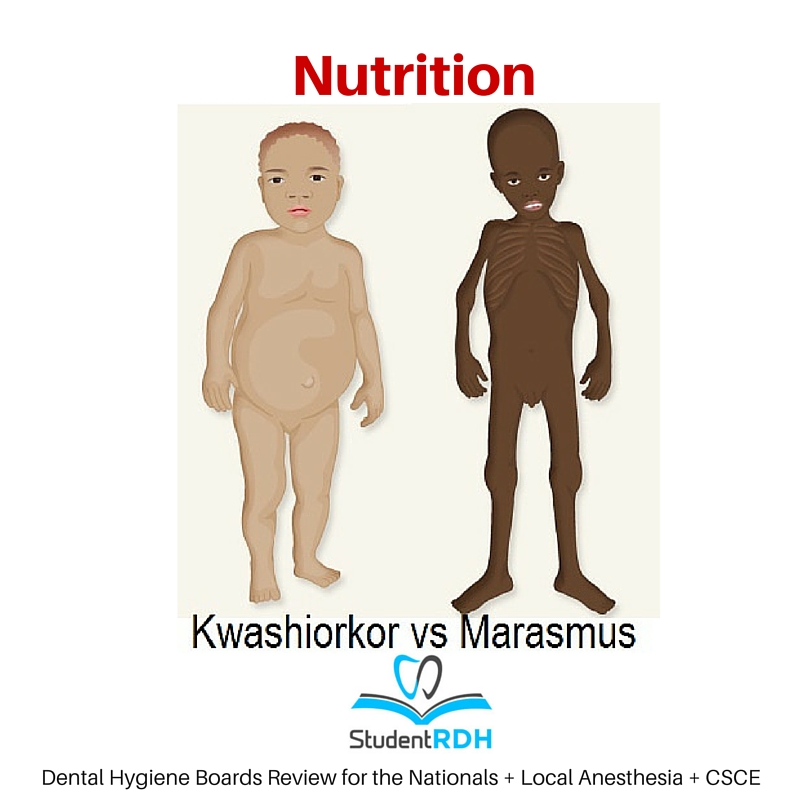 org / 10.1371 / journal.pone.0163779.s001
org / 10.1371 / journal.pone.0163779.s001
(XLSX)
Вклад авторов
- Концептуализация: CML OG KEB.
- Обработка данных: CML.
- Формальный анализ: CML.
- Получение финансирования: CML KEB.
- Расследование: CML SB.
- Методология: CML OG KEB.
- Администрация проекта: CML KEB.
- Ресурсы: OG KEB TF.
- Программное обеспечение: CML.
- Надзор: KEB OG.
- Визуализация: CML.
- Написание – первоначальный эскиз: CML.
- Написание – просмотр и редактирование: CML OG TDL SB TF KEB.
Список литературы
- 1.
Бушби К.М. Генетические и клинические корреляции мышечной дистрофии Xp21.
 Журнал наследственных нарушений обмена веществ. 1992. 15 (4): 551–64. Epub 1992/01/01.pmid: 1528016.
Журнал наследственных нарушений обмена веществ. 1992. 15 (4): 551–64. Epub 1992/01/01.pmid: 1528016. - 2. Хоффман Е.П., Браун Р. Х. младший, Кункель Л. М.. Дистрофин: белковый продукт локуса мышечной дистрофии Дюшенна. Клетка. 1987. 51 (6): 919–28. Epub 1987/12/24. pmid: 3319190.
- 3. Brooke MH, Fenichel GM, Griggs RC, Mendell JR, Moxley R, Florence J, et al. Мышечная дистрофия Дюшенна: закономерности клинического прогрессирования и эффекты поддерживающей терапии. Неврология. 1989. 39 (4): 475–81. Epub 1989/04/01. pmid: 2927672.
- 4. Колер М., Кларенбах К.Ф., Бахлер К., Брак Т., Русси Е.В., Блох К.Е.Инвалидность и выживаемость при мышечной дистрофии Дюшенна. Журнал неврологии, нейрохирургии и психиатрии. 2009. 80 (3): 320–5. Epub 2008/08/21. pmid: 18713792.
- 5.
Смит П.Э., Калверли П.М., Эдвардс Р.Х., Эванс Г.А., Кэмпбелл Е.Дж. Практические проблемы респираторной помощи больным мышечной дистрофией. Медицинский журнал Новой Англии.
 1987. 316 (19): 1197–205. Epub 1987/05/07. pmid: 3553943.
1987. 316 (19): 1197–205. Epub 1987/05/07. pmid: 3553943. - 6. Колер М., Кларенбах К.Ф., Бони Л., Брак Т., Русси Е.В., Блох К.Е.Качество жизни, физическая инвалидность и нарушение дыхания при мышечной дистрофии Дюшенна. Американский журнал респираторной медицины и реанимации. 2005. 172 (8): 1032–6. Epub 18.06.2005. pmid: 15961695.
- 7. Lo Cascio CM, Latshang TD, Kohler M, Fehr T, Bloch KE. Тяжелый метаболический ацидоз у взрослых пациентов с мышечной дистрофией Дюшенна. Дыхание. 2014. 87 (6): 499–503. Epub 2014/05/08. pmid: 24802669.
- 8. Готтран Ф., Гийонно I, Карпентье А.Время сегментарного ободочного транзита при мышечной дистрофии Дюшенна. Архивы болезней в детстве. 1991; 66 (10): 1262. Epub 1991/10/01. pmid: 1953021; PubMed Central PMCID: PMC1793485.
- 9.
Барон Р.Дж., Левин Э.Дж., Олсон Дж.О., Менделл-младший. Снижение моторики желудка при мышечной дистрофии Дюшенна. Медицинский журнал Новой Англии.
 1988. 319 (1): 15–8. Epub 1988/07/07. pmid: 3380114.
1988. 319 (1): 15–8. Epub 1988/07/07. pmid: 3380114. - 10. Borrelli O, Salvia G, Mancini V, Santoro L, Tagliente F, Romeo EF и др. Эволюция электрических характеристик желудка и опорожнения желудка у детей с мышечной дистрофией Дюшенна и Беккера.Американский журнал гастроэнтерологии. 2005. 100 (3): 695–702. Epub 2005/03/04. pmid: 15743370.
- 11. Jaffe KM, McDonald CM, Ingman E, Haas J. Симптомы дисфункции верхних отделов желудочно-кишечного тракта при мышечной дистрофии Дюшенна: исследование случай-контроль. Архивы физической медицины и реабилитации. 1990. 71 (10): 742–4. Epub 1990/09/01. pmid: 2403280.
- 12. Korman SH, Bar-Oz B, Granot E, Meyer S. Время прохождения орокека при мышечной дистрофии Дюшенна. Архивы болезней в детстве.1991; 66 (1): 143–4. pmid: 1994843; PubMed Central PMCID: PMC1793179.
- 13.
Мул Ф, Ваннукки М.Г., Корсани Л., Серио Р., Фауссоне-Пеллегрини МС. Миогенная NOS и продукция эндогенного NO нарушены в толстой кишке дистрофических (mdx) мышей.
 Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 2001; 281 (5): G1264–70. Epub 2001/10/23. pmid: 11668035.
Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 2001; 281 (5): G1264–70. Epub 2001/10/23. pmid: 11668035. - 14. Ваннукки М.Г., Корсани Л., Бани Д., Фауссоне-Пеллегрини М.С. Нейроны кишечника и интерстициальные клетки Кахаля толстой кишки мыши экспрессируют несколько изоформ синтазы оксида азота.Письма о неврологии. 2002. 326 (3): 191–5. Epub 2002/07/04. pmid: 12095654.
- 15. Huizinga JD. Физиология и патофизиология интерстициальной клетки Кахаля: от скамьи к постели. II. Периодичность желудка: уроки мышей-мутантов по медленным волнам и иннервации. Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 2001; 281 (5): G1129–34. Epub 2001/10/23. pmid: 11668020.
- 16. Шах В., Лайфорд Г., Горс Г., Фарруджа Г. Оксид азота в желудочно-кишечном тракте и болезнях.Гастроэнтерология. 2004. 126 (3): 903–13. Epub 2004/02/28. pmid: 14988844.
- 17.
Бушби К., Финкель Р.
 , Бирнкрант Д. Д., Кейс Л. Е., Клеменс П. Р., Крипе Л. и др. Диагностика и лечение мышечной дистрофии Дюшенна, часть 1: диагностика, фармакологическое и психосоциальное лечение. Ланцетная неврология. 2010. 9 (1): 77–93. Epub 2009/12/01. pmid: 19945913.
, Бирнкрант Д. Д., Кейс Л. Е., Клеменс П. Р., Крипе Л. и др. Диагностика и лечение мышечной дистрофии Дюшенна, часть 1: диагностика, фармакологическое и психосоциальное лечение. Ланцетная неврология. 2010. 9 (1): 77–93. Epub 2009/12/01. pmid: 19945913. - 18. Бушби К., Финкель Р., Бирнкрант Д. Д., Кейс Л. Е., Клеменс П. Р., Крипе Л. и др. Диагностика и лечение мышечной дистрофии Дюшенна, часть 2: внедрение многопрофильной помощи.Ланцетная неврология. 2010. 9 (2): 177–89. Epub 2009/12/01. pmid: 19945914.
- 19. Хитон К.В., Гош С., Ф. Брэддон. Насколько тяжелы симптомы и нарушение функции кишечника у пациентов с синдромом раздраженного кишечника? Проспективное контролируемое исследование с упором на форму стула. Кишечник. 1991. 32 (1): 73–9. Epub 1991/01/01. pmid: 1991641; PubMed Central PMCID: PMC1379218.
- 20. Fraser A, Delaney BC, Ford AC, Qume M, Moayyedi P. Краткое исследование валидации анкеты Leeds Dyspepsia.Пищевая фармакология и терапия. 2007. 25 (4): 477–86. Epub 2007/02/03. pmid: 17270004.
- 21. Ревицки Д.А., Рентц А.М., Дюбуа Д., Карилас П., Стангеллини В., Талли Н.Дж. и др. Индекс кардинальных симптомов гастропареза (GCSI): разработка и валидация пациента, сообщившего об оценке тяжести симптомов гастропареза. Исследование качества жизни: международный журнал, посвященный аспектам качества жизни при лечении, уходе и реабилитации. 2004. 13 (4): 833–44. Epub 2004/05/08.pmid: 15129893.
- 22. Дроссман Д.А. Функциональные желудочно-кишечные расстройства и Римский процесс III. Гастроэнтерология. 2006; 130 (5): 1377–90. Epub 2006/05/09. pmid: 16678553.
- 23. Ghoos YF, Maes BD, Geypens BJ, Mys G, Hiele MI, Rutgeerts PJ и др. Измерение скорости опорожнения желудка от твердых веществ с помощью дыхательного теста с октановой кислотой с углеродной меткой. Гастроэнтерология. 1993. 104 (6): 1640–7. Epub 1993/06/01. pmid: 8500721.
- 24. Санака М., Ямамото Т., Накаяма С., Нагасава К., Куяма Ю.Достоверность времени максимальной экскреции [13CO2] и времени полу- [13CO2] выведения как параметра опорожнения желудка: оценки с использованием метода Вагнера-Нельсона. Журнал исследований гладких мышц = Nihon Heikatsukin Gakkai kikanshi. 2007. 43 (5): 201–9. Epub 2007/12/14. pmid: 18075229.
- 25. Гейпенс Б., Беннинк Р., Петерс М., Эвенепоэль П., Мортельманс Л., Маес Б. и др. Валидация дыхательного теста на лактозу- [13C] уреид для определения времени ороцекального транзита с помощью сцинтиграфии.J Nucl Med. 1999. 40 (9): 1451–5. pmid: 10492364.
- 26. Goetze O, Fruehauf H, Pohl D, Giarre M, Rochat F, Ornstein K, et al. Влияние смеси пребиотиков на комфорт кишечника и общее самочувствие. Британский журнал питания. 2008. 100 (5): 1077–85. Epub 2008/04/02. pmid: 18377682.
- 27. Heine WE, Berthold HK, Klein PD. Новый дыхательный тест на стабильный изотоп: меченные 13C гликозилуреиды используются в качестве неинвазивных маркеров времени прохождения через кишечник.Американский журнал гастроэнтерологии. 1995. 90 (1): 93–8. Epub 1995/01/01. pmid: 7801958.
- 28. Adamek RJ, Goetze O, Boedeker C, Pfaffenbach B, Luypaerts A, Geypens B. Дыхательный тест с 13C-метацетином: изотопно-селективная недисперсная инфракрасная спектрометрия в сравнении с масс-спектрометрией изотопного соотношения у добровольцев и пациентов с циррозом печени. Zeitschrift fur Gastroenterologie. 1999. 37 (12): 1139–43. Epub 2000/02/10. pmid: 10666836.
- 29. Goetze O, Selzner N, Fruehauf H, Fried M, Gerlach T., Mullhaupt B.Дыхательный тест с 13С-метацетином как количественный тест функции печени у пациентов с хроническим гепатитом С: непрерывная автоматическая молекулярно-корреляционная спектроскопия по сравнению с масс-спектрометрией изотопных соотношений. Пищевая фармакология и терапия. 2007. 26 (2): 305–11. Epub 2007/06/27. pmid: 17593076.
- 30.
Wutzke KD, Heine WE, Plath C, Leitzmann P, Radke M, Mohr C и др. Оценка времени прохождения орокекала: сравнение лактозо- [13C, 15N] уреида 13CO2- и дыхательного теста на лактулозу h3 у людей.Европейский журнал лечебного питания. 1997. 51 (1): 11–9. Epub 1997/01/01. pmid:
61.
- 31. Goetze O, Wieczorek J, Mueller T, Przuntek H, Schmidt WE, Woitalla D. Нарушение опорожнения желудка от твердой пробной еды у пациентов с болезнью Паркинсона с использованием дыхательного теста с 13C-октаноатом натрия. Письма о неврологии. 2005. 375 (3): 170–3. pmid: 15694254.
- 32. Меткалф А.М., Филлипс С.Ф., Зинсмайстер А.Р., Маккарти Р.Л., Беарт Р.В., Вольф Б.Г. Упрощенная оценка сегментарного толстокишечного транзита.Гастроэнтерология. 1987. 92 (1): 40–7. Epub 1987/01/01. pmid: 3023168.
- 33. Мейер Р., Беглингер С., Пуллвитт А., Мейер-Висс Б., Бриньоли Р. [Насколько надежно измерение времени прохождения через толстую кишку с использованием маркерной техники?]. Schweizerische medizinische Wochenschrift. 1995. 125 (39): 1830–3. Epub 1995/09/30. pmid: 7481641.
- 34. Ревицки Д.А., Рентц А.М., Дюбуа Д., Карилас П., Стангеллини В., Талли Н.Дж. и др. Разработка и валидация оценки тяжести симптомов гастропареза, оцениваемой пациентом: Индекс кардинальных симптомов гастропареза.Пищевая фармакология и терапия. 2003. 18 (1): 141–50. Epub 2003/07/10. pmid: 12848636.
- 35. Цой М.Г., Камиллери М., Бертон Д.Д., Зинсмайстер А.Р., Форстром Л.А., Наир К.С. Воспроизводимость и упрощение дыхательного теста с 13C-октановой кислотой для опорожнения желудка от твердых веществ. Американский журнал гастроэнтерологии. 1998. 93 (1): 92–8. pmid: 9448183.
- 36. Дикман Р., Зилпер Т., Стейнмец А., Паканаев Л., Рон И., Бернстин Х. и др. Сравнение непрерывного дыхательного теста и сцинтиграфии желудка для измерения скорости опорожнения желудка у здоровых людей и людей, страдающих диспепсией.Eur J Gastroenterol Hepatol. 2013; 25 (3): 291–5. pmid: 23354159.
- 37. Bromer MQ, Kantor SB, Wagner DA, Knight LC, Maurer AH, Parkman HP. Одновременное измерение опорожнения желудка с простой маффиновой едой с использованием дыхательного теста [13C] октаноата и сцинтиграфии у здоровых субъектов и пациентов с диспепсическими симптомами. Заболевания органов пищеварения и науки. 2002. 47 (7): 1657–63. pmid: 12141833.
- 38. Maes BD, Ghoos YF, Rutgeerts PJ, Hiele MI, Geypens B, Vantrappen G.[* C] Дыхательный тест с октановой кислотой для измерения скорости опорожнения желудка от твердых веществ. Заболевания органов пищеварения и науки. 1994; 39 (12 доп.): 104С – 6С. Epub 1994/12/01. pmid: 7995200.
- 39. Palit S, Lunniss PJ, Scott SM. Физиология дефекации человека. Заболевания органов пищеварения и науки. 2012. 57 (6): 1445–64. WOS: 000304396700006. pmid: 22367113
- 40. Байерс Т.Дж., Лидов Х.Г., Кункель Л.М. Альтернативный транскрипт дистрофина, специфичный для периферического нерва. Генетика природы. 1993. 4 (1): 77–81.pmid: 8513330.
- 41. Blake DJ, Schofield JN, Zuellig RA, Gorecki DC, Phelps SR, Barnard EA и др. G-утрофин, аутосомный гомолог дистрофина Dp116, экспрессируется в сенсорных ганглиях и головном мозге. Труды Национальной академии наук Соединенных Штатов Америки. 1995. 92 (9): 3697–701. pmid: 7731967; PubMed Central PMCID: PMC42028.
Мышечная дистрофия – Симптомы и причины
Обзор
Мышечная дистрофия – это группа заболеваний, вызывающих прогрессирующую слабость и потерю мышечной массы.При мышечной дистрофии аномальные гены (мутации) препятствуют выработке белков, необходимых для формирования здоровых мышц.
Есть много видов мышечной дистрофии. Симптомы самого распространенного разнообразия начинаются в детстве, в основном у мальчиков. Другие типы не появляются до зрелого возраста.
Нет лекарства от мышечной дистрофии. Но лекарства и терапия могут помочь справиться с симптомами и замедлить течение болезни.
Продукты и услуги
Показать больше товаров от Mayo ClinicСимптомы
Основным признаком мышечной дистрофии является прогрессирующая мышечная слабость.Специфические признаки и симптомы начинаются в разном возрасте и в разных группах мышц, в зависимости от типа мышечной дистрофии.
Мышечная дистрофия Дюшенна
Это наиболее распространенная форма. Хотя девочки могут быть переносчиками и иметь легкое поражение, это гораздо чаще встречается у мальчиков.
Признаки и симптомы, которые обычно появляются в раннем детстве, могут включать:
- Частые падения
- Затруднения при вставании из положения лежа или сидя
- Проблемы с бегом и прыжками
- Веревочная походка
- Ходьба на цыпочках
- Большие икроножные мышцы
- Боль и скованность в мышцах
- Нарушения обучаемости
- Отсроченный рост
Мышечная дистрофия Беккера
Признаки и симптомы сходны с таковыми при мышечной дистрофии Дюшенна, но имеют тенденцию быть более легкими и прогрессировать медленнее.Симптомы обычно начинаются в подростковом возрасте, но могут появиться не ранее 20 лет или позже.
Другие типы мышечной дистрофии
Некоторые типы мышечной дистрофии определяются специфическим признаком или местом начала симптомов в организме. Примеры включают:
- Миотонический. Характеризуется неспособностью расслабить мышцы после сокращения. Обычно в первую очередь поражаются мышцы лица и шеи. У людей с этой формой обычно длинные тонкие лица; опущенные веки; и лебединые шеи.
- Facioscapulohumeral (FSHD). Мышечная слабость обычно начинается с лица, бедер и плеч. Лопатки могут выступать, как крылья, когда руки подняты. Начало обычно происходит в подростковом возрасте, но может начаться в детстве или в возрасте 50 лет.
- Врожденный. Этот тип поражает мальчиков и девочек и проявляется при рождении или в возрасте до 2 лет. Некоторые формы прогрессируют медленно и вызывают лишь легкую инвалидность, в то время как другие быстро прогрессируют и вызывают серьезные нарушения.
- Конечностный пояс. Обычно в первую очередь поражаются мышцы бедра и плеча. Люди с этим типом мышечной дистрофии могут испытывать трудности с поднятием передней части стопы и часто спотыкаются. Начало обычно начинается в детстве или подростковом возрасте.
Когда обращаться к врачу
Обратитесь за медицинской помощью, если вы заметили признаки мышечной слабости – например, повышенную неуклюжесть и падение – у вас или вашего ребенка.
Причины
Определенные гены участвуют в производстве белков, защищающих мышечные волокна.Мышечная дистрофия возникает при дефекте одного из этих генов.
Каждая форма мышечной дистрофии вызывается генетической мутацией, характерной для данного типа заболевания. Большинство этих мутаций передаются по наследству.
Факторы риска
Мышечная дистрофия встречается у представителей обоих полов, всех возрастов и рас. Однако наиболее распространенная разновидность, Дюшенн, обычно встречается у мальчиков. Люди с семейным анамнезом мышечной дистрофии подвергаются более высокому риску развития заболевания или передачи его своим детям.
Осложнения
К осложнениям прогрессирующей мышечной слабости относятся:
- Проблемы при ходьбе. Некоторым людям с мышечной дистрофией в конечном итоге необходимо использовать инвалидное кресло.
- Проблемы с использованием оружия. Повседневная деятельность может стать труднее, если затронуты мышцы рук и плеч.
- Укорочение мышц или сухожилий вокруг суставов (контрактуры). Контракты могут еще больше ограничить мобильность.
- Проблемы с дыханием. Прогрессирующая слабость может влиять на мышцы, отвечающие за дыхание. Людям с мышечной дистрофией, возможно, в конечном итоге потребуется использовать устройство для обеспечения дыхания (вентилятор), сначала ночью, но, возможно, также и днем.
- Искривление позвоночника (сколиоз). Ослабленные мышцы могут не удерживать позвоночник прямо.
- Проблемы с сердцем. Мышечная дистрофия может снизить эффективность сердечной мышцы.
- Проблемы с глотанием. Если поражены мышцы, участвующие в глотании, могут развиться проблемы с питанием и аспирационная пневмония. Питательные трубки могут быть вариантом.
31 января 2020 г.
Миотоническая дистрофия (DM) – болезни
Миотоническая дистрофия (DM)
Что такое миотоническая дистрофия (МД)?
Миотоническая дистрофия (DM) – это форма мышечной дистрофии, которая поражает мышцы и многие другие органы тела.
Слово «миотонический» – это прилагательная форма слова «миотония», определяемая как неспособность расслабить мышцы по желанию.
Термин «мышечная дистрофия» означает прогрессирующую мышечную дегенерацию со слабостью и сокращением мышечной ткани.
Миотоническая дистрофия часто сокращается как «DM» в связи с ее греческим названием dystrophia myotonica. Другое название, которое иногда используется для этого расстройства, – болезнь Штейнерта, в честь немецкого врача, который впервые описал это расстройство в 1909 году.
Что вызывает DM?
DM делится на два типа.
СД 1 типа (DM1), давно известный как болезнь Штейнерта, возникает, когда ген на хромосоме 19, называемый DMPK , содержит аномально расширенный участок, расположенный рядом с регуляторной областью другого гена, SIX5 .
СД 2 типа (DM2), признанный в 1994 году более мягкой версией СД1, вызван аномально разросшейся частью гена на хромосоме 3, называемого ZNF9 . Первоначально СД2 назывался ПРОММ (проксимальная миотоническая миопатия), термин, который до сих пор используется, но встречается несколько реже, чем термин СД2.
Расширенные участки ДНК в этих двух генах, по-видимому, оказывают множество сложных эффектов на различные клеточные процессы. И в DM1, и в DM2 расширение повторов транскрибируется в РНК, но остается нетранслируемой в белке.
Эти состояния являются одними из наиболее распространенных форм мышечной дистрофии у взрослых. СД – наиболее распространенная мышечная дистрофия среди взрослых европейцев. Распространенность СД составляет около 10 случаев на 100 000 человек. 1,2,3,4 Среди небелого населения СД1 встречается редко или редко. 5,6,7,8 Согласно сообщениям из Европы, распространенность СД2 аналогична распространенности СД1.
Каковы симптомы DM?
DM вызывает слабость произвольных мышц, хотя степень слабости и наиболее пораженные мышцы сильно различаются в зависимости от типа DM и возраста человека с заболеванием.
Миотония, неспособность расслаблять мышцы по желанию, является еще одной особенностью DM. Например, кому-то с DM может быть трудно отпустить чью-то руку после того, как она пожала ее.
По мере прогрессирования болезни у сердца может развиться ненормальный ритм, и сердечная мышца может ослабнуть. Мышцы, используемые для дыхания, могут ослабевать, вызывая нарушение дыхания, особенно во время сна. 9
Кроме того, при СД 1 типа могут поражаться непроизвольные мышцы, например мышцы желудочно-кишечного тракта. Могут возникнуть затрудненное глотание, запоры и камни в желчном пузыре. 10,11 У женщин мышцы матки могут работать ненормально, что приводит к осложнениям во время беременности и родов. 12,13
Развитие катаракты (непрозрачных пятен на линзах глаз) в относительно раннем возрасте является еще одной характеристикой СД как для 1-го, так и для 2-го типа. 14
Общий интеллект обычно нормален у людей с СД, но неспособность к обучению и апатичное поведение обычны для формы типа 1. 15 При врожденном СД1, который поражает детей с момента рождения, может наблюдаться серьезное нарушение когнитивных функций. У этих детей также могут быть проблемы с речью, слухом, 16 и зрение.
Как правило, чем раньше начинается СД1, тем серьезнее симптомы. Для получения дополнительной информации см. Признаки и симптомы.
DM2 имеет лучший общий прогноз, чем DM1. Симптомы часто относительно легкие и медленно прогрессируют. СД2 редко возникает в детстве, и врожденная форма СД2 неизвестна.
Как прогрессирует DM?
Развитие СД сильно различается у разных людей, но в целом симптомы прогрессируют постепенно. Ожидаемая продолжительность жизни явно снижается у пациентов с врожденным СД1 и, вероятно, снижается у пациентов с СД1 в детском возрасте и с классическим (у взрослых) СД1.
Самый распространенный тип СД1 – взрослая форма – начинается в подростковом или юношеском возрасте, часто со слабостью мышц лица, шеи, пальцев и лодыжек. Слабость этих и, в конечном итоге, других мышц постепенно прогрессирует.
Когда СД1 начинается раньше, чем в подростковом возрасте – это врожденная форма болезни и болезнь, начавшаяся в детстве, – он может сильно отличаться по прогрессии от взрослого типа. Дети с врожденным диабетом 1 типа после того, как они пережили критический неонатальный период слабости дыхательных мышц с помощью вспомогательной вентиляции легких, обычно демонстрируют улучшение двигательной и дыхательной функций.У них могут быть когнитивные нарушения, задержка речи, трудности с едой и питьем, а также различные другие задержки в развитии. 15
Детская форма СД1 в возрасте до 10 лет чаще характеризуется когнитивными и поведенческими аномалиями, чем физическими недостатками, такими как интеллектуальные нарушения, дефицит внимания, исполнительная дисфункция, тревожность и расстройства настроения. 17, 18, 19 Со временем в той или иной степени развиваются мышечные симптомы.
СД2 в целом более легкое заболевание, чем тип 1.Он не имеет врожденной формы и редко начинается в детстве.
В отличие от СД 1 типа, при СД2 первыми поражаются проксимальные мышцы, расположенные близко к центру тела, особенно вокруг бедер. Тем не менее, некоторая слабость пальцев может быть замечена и раньше. Заболевание прогрессирует медленно, но подвижность может быть нарушена на ранней стадии из-за слабости крупных, несущих вес мышц.
Каков статус исследований DM?
Идентификация генетических мутаций, лежащих в основе СД1 и СД2, и понимание, по крайней мере частично, того, как мутации вызывают заболевание, открыли возможности для развития терапии СД.
Большинство разрабатываемых в настоящее время стратегий направлено на блокирование вредного воздействия расширенной ДНК в гене DMPK (тип 1) или гене ZNF9 (тип 2). Для получения дополнительной информации см. «Исследования в фокусе: миотоническая дистрофия» и, в частности, «Исследования DM: поиск свободных белков из« токсичной сети »».
Загрузите наш информационный бюллетень о миотонической дистрофии (DM)
Список литературы
- Общие сведения о лечении нервно-мышечных заболеваний. Институт IQVIA.Парсиппани, штат Нью-Джерси. (2018).
- Маги, А. и Невин, Н. С. Эпидемиология миотонической дистрофии в Северной Ирландии. Геномика общественного здравоохранения (2003). DOI: 10.1159 / 000016209
- Siciliano, G. et al. Эпидемиология миотонической дистрофии в Италии: повторное обследование после генетической диагностики. Clin. Genet. (2001). DOI: 10.1034 / j.1399-0004.2001.5 .x
- Норвуд, Ф. Л. М. et al. Распространенность генетических заболеваний мышц в Северной Англии: углубленный анализ населения клиники мышц. Мозг (2009 г.). DOI: 10.1093 / мозг / awp236
- Лотц, Б. П. и ван дер Мейден, К. Х. Миотоническая дистрофия. Часть I. Генеалогическое исследование северного Трансвааля. S Afr Med J (1985).
- Ашизава Т. и Эпштейн Х. Ф. Этническое распределение гена миотонической дистрофии. Ланцет (1991). DOI: 10.1016 / 0140-6736 (91)
- -D
- Hsiao, K. M. et al. Эпидемиологические и генетические исследования миотонической дистрофии 1 типа на Тайване. Нейроэпидемиология (2003). DOI: 10.1159 / 000071191
- Голдман А., Рамзи М. и Дженкинс Т. Этническая принадлежность и миотоническая дистрофия: возможное объяснение ее отсутствия в странах Африки к югу от Сахары. Ann. Гм. Genet. (1996). DOI: 10.1111 / j.1469-1809.1996.tb01172.x
- Кулебрас, А. Сон и нервно-мышечные расстройства. Неврологическая клиника (2005). DOI: 10.1016 / j.ncl.2005.08.004
- Hageman, A. T. M., Gabreëls, F. J. M., Liem, K. D., Renkawek, K.И Бун, Дж. М. Врожденная миотоническая дистрофия; отчет о тринадцати случаях и обзор литературы. J. Neurol. Sci. (1993). DOI: 10.1016 / 0022-510X (93) -7
- Bellini, M. et al. Желудочно-кишечные проявления при миотонической мышечной дистрофии. Всемирный журнал гастроэнтерологии (2006 г.). DOI: 10.3748 / wjg.v12.i12.1821
- R.N., S. & T.B., M. Беременность с миотоаидной дистрофией. Конечно, осложнения и лечение. Акушерство.Gynec. (1971).
- Сарнат, Х. Б., О’Коннор, Т. и Бирн, П. А. Клинические эффекты миотонической дистрофии на беременность и новорожденных. Arch. Neurol. (1976). DOI: 10.1001 / archneur.1976.00500070001001
- Arsenault, M.E. et al. Клиническая характеристика пациентов с миотонической дистрофией 1 типа с небольшими расширениями КТГ. Неврология (2006). DOI: 10.1212 / 01.wnl.0000208513.48550.08
- Роиг, М., Баллиу, П. Р., Наварро, К., Бругера, Р.И Лосада М. Презентация, клиническое течение и исход врожденной формы миотонической дистрофии. Pediatr. Neurol. (1994). DOI: 10.1016 / 0887-8994 (94)
-X
- Van Vliet, J. et al. Нарушение слуха у пациентов с миотонической дистрофией 2 типа. Неврология (2018). DOI: 10.1212 / WNL.0000000000004963
- Удд, Б. и Крахе, Р. Миотонические дистрофии: молекулярные, клинические и терапевтические проблемы. Ланцетная неврология (2012).DOI: 10.1016 / S1474-4422 (12) 70204-1
- Экстрём, А. Б., Хакенес-Плейт, Луиза, Тулиниус, М. и Венц, Э. Познавательные и адаптивные навыки при миотонической дистрофии 1 типа: исследование 55 человек с врожденными и детскими формами. Dev. Med. Детский Neurol. (2009 г.). DOI: 10.1111 / j.1469-8749.2009.03300.x
- Douniol, M. et al. Психиатрический и когнитивный фенотип детской миотонической дистрофии 1 типа. Dev. Med. Детский Neurol. (2012). DOI: 10.1111 / j.1469-8749.2012.04379.x
Мышечная дистрофия пояса конечностей: рентгенологическое и манометрическое исследование глотки и пищевода
Banker BQ, Engel AG: синдромы полимиозита и дерматомиозита. В: Engel AG, Banker BQ (ред.): Myology , том 2. Нью-Йорк: McGraw-Hill, 1986, стр 1385–1422
Google Scholar
Harper PS: Миотоническая дистрофия . Филадельфия: У. Б. Сондерс, 1979
Google Scholar
Томе ФМС, Фардо М: Глазные миопатии. В: Engel AG, Banker BQ (ред.): Myology , vol 2. Нью-Йорк: McGraw-Hill, 1986, стр 1327–1347
Google Scholar
Уолтон Дж. Н., Наттрасс Ф. Дж .: О классификации, естественном течении и лечении миопатий. Мозг 77 : 169–231, 1954
PubMed Google Scholar
Bradley WG: Синдромы пояса конечностей.В: Vinken PJ, Bruyn GW (ред.): Справочник по клинической неврологии , том 40. Амстердам: Северная Голландия, 1979, стр. 433–469
Google Scholar
Shields RW: Синдромы пояса конечностей. В: Engel AG, Banker BQ (ред.): Myology , vol 2. Нью-Йорк: McGraw-Hill, 1986, стр 1349–1365
Google Scholar
Yates JRW, Emery AEH: популяционное исследование начинающейся у взрослых мышечной дистрофии конечностей и поясов. J Med Genet 22 : 250–257 1985
PubMed Google Scholar
Панегирес П.К., Масталья Ф.Л., Какулас Б.А.: Синдромы пояса конечностей: клинические, морфологические и электрофизиологические исследования. J Neurol Sci 95 : 201–218, 1990
Статья PubMed Google Scholar
Mendell JR, Florence J: Ручное мышечное тестирование. Muscle Nerve 13 (Suppl): 16–20, 1990
PubMed Google Scholar
Dodds WJ: Радиология (пищевода и пищеводно-желудочной области). В: Margulis AR, Burhenne HJ (ред.): Радиология пищеварительного тракта, том 1. Сент-Луис: Mosby CV, 1983, стр 529–603
Google Scholar
Матрос В.Б .: Радиология (глотки). В: Margulis AR, Burhenne HJ (ред.): Радиология пищеварительного тракта , том 1. Сент-Луис: Mosby CV, 1983, стр. 491–518
Google Scholar
Richter JE, Wu WC, Johns DN, Blackwell JN, Nelson JL, Castell JA, Castell DO: Манометрия пищевода у 95 здоровых взрослых добровольцев. Изменчивость давления с возрастом и частота «ненормальных» сокращений. Dig Dis Sci 32 : 583–592, 1987
PubMed Google Scholar
Доддс В.Дж., Хоган В.Дж., Стеф Дж.Дж., Миллер В.Н., Лайдон С.Б., Андорфер Р.К.: метод быстрого протягивания для измерения давления нижнего сфинктера пищевода. Гастроэнтерология 68 : 437–443, 1975
PubMed Google Scholar
Велч Р.В., Лакман К., Рикс П.М., Дрейк С.Т.: Манометрия нормального верхнего сфинктера пищевода и его изменение при ларингэктомии. J Clin Invest 63 : 1036–1041, 1979
PubMed Google Scholar
Winans CS: Механизм закрытия глотки и пищевода: манометрическое исследование. Гастроэнтерология 63 : 768–777, 1972
PubMed Google Scholar
Castell JA, Castell DO: Современная твердотельная компьютеризированная манометрия глоточно-пищеводного сегмента. Дисфагия 8 : 270–275, 1993
PubMed Google Scholar
Castell DO, Richter JE, Dalton CB: Тестирование моторики пищевода. Нью-Йорк: Эльзевир, 1987
Google Scholar
Джексон К.Э., Стрелер Д.А.: Мышечная дистрофия пояса конечностей: клинические проявления и выявление доклинических заболеваний. Педиатрия 41 : 495–502, 1968
PubMed Google Scholar
Демейстер Т.Р., Даннингтон Г.Л.: Анатомия и физиология пищевода. В: Гринфилд Л.Дж., Малхолланд М.В., Олдхэм К.Т., Зеленок Г.Б. (ред.): Хирургия: научные принципы и практика . Филадельфия: JB Lippencott, 1993, стр 593–621
Google Scholar
«Урожай кукурузы» Питера Брейгеля Старшего, 1565 | Бангладешский мужчина работает на рисовом поле Источник: USAID / Федеральное правительство | Бойня крупного рогатого скота, удовлетворяющая новые потребности потребления мяса Источник: Public Domain – выпущено Dr.Темпл Грандин |
Коллекция мясных продуктов для употребления в пищу | Фред Мейер из Портленда, штат Орегон, демонстрирует обычный выбор продуктов питания в супермаркете в США Источник: Лицензия http://www.flickr.com/photos/lyza/49545547 | Тучный подросток мужского пола (5 футов 10 дюймов, 322 фунта, вид спереди и сбоку) Источник: передано в общественное достояние |
Трактор John Deere на уборке урожая | Ресторан McDonald’s в Эр-Рияде в Саудовской Аравии, отражающий распространение западной кухни и диетических практик Источник: Лицензия GNU (пользователь haitham alfalah) | Фотография голодающей женщины из блокады Ленинграда во время Великой Отечественной войны. Этот отрывок примерно переводится как «Пищевая дистрофия (голодная болезнь). Нарушение общего питания организма в результате длительного периода недоедания, когда пища не содержит достаточного количества калорий по отношению к затраченной энергии. После война, дистрофия получила другое, неофициальное название «Ленинградская болезнь» .Источник: Creative Commons (Георгий Шуклин) |
Пропагандистский плакат “Большой скачок вперед” в Китае, созданный для того, чтобы производство зерна выглядело как стреляющие ракеты. | Набросок Бриджит О’Доннел, которая вместе со своими детьми перенесла серьезную болезнь во время ирландского картофельного голода в 1849 году | Молодой нигерийский ребенок в конце 1960-х годов, страдающий от белковой недостаточности, квашиоркора, после нигерийско-биафранской войны Источник: Центр по контролю за заболеваниями |
18-месячная девочка весом 14 фунтов находится на лечении у медицинской бригады армии США в провинции Пактия, Афганистан.Декабрь 2007 Источник: Public Domain-US Army | Автобус, работающий на соевом биодизеле, одном из альтернативных способов отвлечения сельскохозяйственных продуктов от пищевых продуктов Источник: Министерство энергетики США | Ребенок – жертва голодомора на Украине, 1933 г. |
Дети и медсестра в нигерийском приюте в 1960-е годы.У некоторых детей наблюдаются признаки квашиоркора, белковой недостаточности .Источник: Центр по контролю за заболеваниями | Обычно выращиваемые во всем мире продукты питания, богатые естественными сложными и простыми углеводами Источник: Public Domain – Министерство сельского хозяйства | Гравюра “Раздача кукурузы людям в сезон нехватки”.”Китайские чиновники, распределяющие помощь голодающим в начале 19 века |
Итальянская памятная монета номиналом 2 евро с изображением Всемирной продовольственной программы, 2004 г. | Органическое выращивание овощных смесей в Калифорнии, новое направление в сельскохозяйственном производстве | Трактор вспахивает поле люцерны в 1921 году |
Водяной буйвол вспахивает рисовые поля возле Салатига, Центральная Ява, Индонезия Источник: Лицензия GNU (Мербабу) |

 Температура тела понижается до тридцати градусов. Возможно развитие голодной комы.
Температура тела понижается до тридцати градусов. Возможно развитие голодной комы.
 Журнал наследственных нарушений обмена веществ. 1992. 15 (4): 551–64. Epub 1992/01/01.pmid: 1528016.
Журнал наследственных нарушений обмена веществ. 1992. 15 (4): 551–64. Epub 1992/01/01.pmid: 1528016.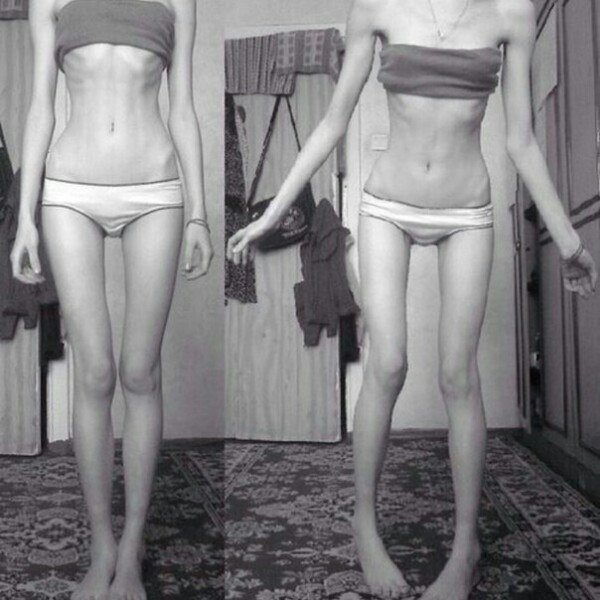 1987. 316 (19): 1197–205. Epub 1987/05/07. pmid: 3553943.
1987. 316 (19): 1197–205. Epub 1987/05/07. pmid: 3553943.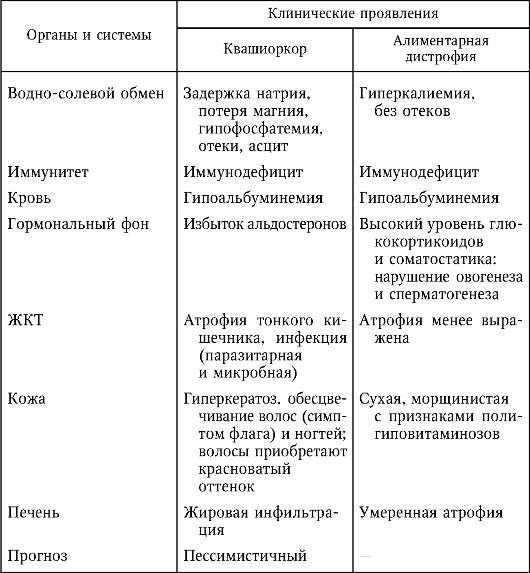 1988. 319 (1): 15–8. Epub 1988/07/07. pmid: 3380114.
1988. 319 (1): 15–8. Epub 1988/07/07. pmid: 3380114. Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 2001; 281 (5): G1264–70. Epub 2001/10/23. pmid: 11668035.
Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 2001; 281 (5): G1264–70. Epub 2001/10/23. pmid: 11668035. , Бирнкрант Д. Д., Кейс Л. Е., Клеменс П. Р., Крипе Л. и др. Диагностика и лечение мышечной дистрофии Дюшенна, часть 1: диагностика, фармакологическое и психосоциальное лечение. Ланцетная неврология. 2010. 9 (1): 77–93. Epub 2009/12/01. pmid: 19945913.
, Бирнкрант Д. Д., Кейс Л. Е., Клеменс П. Р., Крипе Л. и др. Диагностика и лечение мышечной дистрофии Дюшенна, часть 1: диагностика, фармакологическое и психосоциальное лечение. Ланцетная неврология. 2010. 9 (1): 77–93. Epub 2009/12/01. pmid: 19945913.