Допплер при беременности в Минске
Допплерометрия (синоним, допплерография) фето-плацентарного кровотока – это исследование состояния кровотока в системе «мать-плацента-плод», которое проводят во время ультразвукового исследования при беременности.
Результаты допплерографии позволяют судить о состоянии маточно–плацентарно–плодового кровотока и косвенно свидетельствуют о внутриутробном состоянии ребенка.
Физический эффект, применяемый в современной медицине для измерения скорости кровотока, открыл в 1842 году Христиан Иоганн Доплер, профессор математики и геометрии. Широкое распространение допплерометрия в акшерстве получила с середины 80 годов 20 века. Наиболее часто применяемые доплеровские методики при сканировании во время беременности следующие: импульсный, цветной (цветовой), энергетический допплеры.
Импульсный допплер.
Сущность эффекта Доплера сводится к тому, что при отражении ультразвуковых волн от движущихся объектов (в нашем случае такими объектами являются кровяные клетки, движущиеся по сосудам) изменяются физические свойства волны.

Цветной допплер.
Эта методика основана на применении того же частотного сдвига, только после преобразования сигналов на экране монитора появляется изображение сосудов, обычно красного и синего цвета. С помощью этой методики нельзя определить расчетные индексы, но можно охарактеризовать особенности кровотока в органе, проследить ход сосудов.
Часто цветной и импульсный допплер используются в комбинации – цветной для нахождения сосуда, импульсный для оценки скорости кровотока в нем.
При ультразвуковом исследовании во время беременности режим цветного допплера используется очень часто. Так такие опасные состояния как предлежание сосудов плаценты к шейке матки, истинный узел пуповины, многократное обвитие пуповины вокруг шеи плода, рак шейки матки можно диагностировать с помощью этой методики. Кроме этого, цветной допплер применяется при каждом исследовании сердца плода и помогает обнаружить пороки сердца.
Энергетический допплер.
Еще одна из методик оценки кровоснабжения изучаемого объекта. Изменение амплитудных характеристик волны преображается в аппарате и на мониторе видны сосуды обычно оранжевого цвета. Эта методика в акушерстве применяется не часто.
Показания для проведения допплерометрии.
Основными показаниями для оценки кровотока в системе мать-плацента-плод являются:
1.Заболевания матери:
- гестоз, артериальная гипертензия,
- заболевания почек,
- коллагенозы,
- антифосфолипидный синдром и другие аутоиммунные состояния
- врожденные тромбофилии
- сахарный диабет
2.Заболевания плода, плаценты, пуповины:
- отставание в размерах
- маловодие,многоводие
- многоплодная беременность
- нарушение созревания плаценты
- неименная водянка, пороки развития плода, аномалии пуповины, хромосомные аномалии плода
- патологические типы КТГ
- пороки развития и подозрение на хромосомную патологию
3. Отягощённый акушерский анамнез (ЗВРП, гестоз, мертворождения при предыдущих беременностях).
Отягощённый акушерский анамнез (ЗВРП, гестоз, мертворождения при предыдущих беременностях).
Оценка кровотока в бассейне плаценты.
Оценка плацентарного кровотока включает в себя измерение индексов сопротивления в артерии пуповины и в обеих маточных артериях. Нарушение кровотока в пуповине свидетельствует о неполадках в плодовой части плаценты. Нарушение кровотока в маточных артериях говорит о сбое в работе маточной части плаценты. Необходимо знать, что нормальные показатели кровотока служат достаточно достоверным признаком нормального внутриутробного состояния плода, но полностью не исключают развития определенных осложнений; наличие нарушений кровотока в разных отделах маточно-плацентарно-плодовой системы требует строгого динамического контроля и лечения, в том числе в условиях стационара.
Оценка кровообращения плода.
Гемодинамика малыша обычно оценивается при исследовании кровотока в мозговых сосудах (средняя мозговая артерия), аорте, венозном протоке, сердце.
Классификация нарушений маточно-плацентаро-плодового кровотока.
Наиболее часто применяемая, простая и удобная классификация нарушений плацентарного кровотока изложена ниже.
1 степень
А.Нарушение маточно-плацентарного кровотока при сохранении плодово-плацентарного ( повышены индексы сопротивления в маточных артериях)
Б.Нарушение плодово-плацентарного кровотока при сохранении маточно-плацентарного (повышены индексы сопротивления в артерии пуповины)
2 степень
Одновременное нарушение маточно-плацентарного и плодово-плацентарного кровотока (повышены индексы сопротивления в артерии пуповиныи в маточных артериях)
3 степень
Критическое нарушение плодово-плацентарного кровотока (нарушение кровотока в пуповине) – отсутствует диастолический кровоток в артерии пуповины или даже появляется реверсный (обратный) кровоток.
Проведя оценку кровотока в сосудах плаценты и плода, врач делает соответствующие выводы и формулирует заключение.
Необходимо помнить:
* Допплерометрия – это дополнительная методика, которая применяется после проведения ультразвукового исследования.
* Показания к проведению допплерометрии определяет врач. Без показаний такое исследование проводить не стоит.
* Частоту проведения допплерометрии определяет врач. Иногда требуется ежедневный контроль за состоянием кровотока мать-плод
* Нормальные результаты при допплерометрии не отменяют результатов других исследований и не гарантируют отсутствие внутриутробного страдания плода.
Плацентарная недостаточность – что это и как лечить
Большинство женщин знают, что плацента связывает маму и малыша во время беременности и при помощи нее к малышу поступают питательные вещества и кислород. Бывают ли такие ситуации, когда плацента перестает правильно и полноценно выполнять свою функцию? Можно ли как то предотвратить это?
Какую функцию выполняет плацента
Итак, плацента – это важный орган, который образуется только во время беременности. Образуется плацента из хориона – зародышевых оболочек плода. В самом начале беременности ворсины хориона – выросты оболочки – равномерно покрывают всю поверхность плодного яйца, начиная со второго месяца беременности с одной стороны плодного яйца ворсины начинают удлиняться, увеличиваться в размерах и формируют плаценту.
Образуется плацента из хориона – зародышевых оболочек плода. В самом начале беременности ворсины хориона – выросты оболочки – равномерно покрывают всю поверхность плодного яйца, начиная со второго месяца беременности с одной стороны плодного яйца ворсины начинают удлиняться, увеличиваться в размерах и формируют плаценту.
Внутри ворсин течет кровь малыша, а снаружи они омываются кровью матери. Между кровотоком мамы и малыша расположен всего один слой клеток, который и играет роль барьера между организмом матери и ребенка. Благодаря этой мембране кровь матери и плода не смешивается.
Однако в последние годы стало известно, что клетки крови плода все-таки проникают через плацентарный барьер в кровоток матери и благодаря этому стало возможным проведение генетических анализов и определение хромосомных аномалий, резуса фактора и пола плода по крови беременной женщины (неинвазивный пренатальный тест).

Плацентарный барьер выполняет иммунологическую функцию, поскольку пропускает некоторые защитные антитела – клетки крови, обеспечивающие борьбу с инфекционными агентами, кроме того он является непроницаемым для некоторых вредных веществ, вирусов и бактерий. К сожалению, плацентарный барьер легко преодолевают наркотические вещества, алкоголь, никотин, компоненты многих лекарств и некоторые вирусы.
Важной функцией плаценты является выработка гормонов и биологически активных веществ. В первую очередь это гормоны, важные для успешного вынашивания беременности, например хорионический гонадотропин, плацентарный лактоген, эстрогены и др.
К сожалению, не всегда все складывается вполне благополучно. В силу самых различных причин на разных сроках беременности могут происходить отклонения в развитии и функционировании плаценты. Изменения эти никогда не проходят бесследно для мамы и малыша, а зачастую имеют грозные последствия.
Если плацента перестает выполнять свои функции в полной мере, развивается так называемая плацентарная недостаточность. По сути, она заключается в ухудшении кровообращения в системе мать-плацента-плод.
По сути, она заключается в ухудшении кровообращения в системе мать-плацента-плод.
Виды и причины плацентарной недостаточности
Врачи различают острую и хроническую плацентарную недостаточность:
Острая плацентарная недостаточность – это состояние, требующее экстренного вмешательства врачей. Она характеризуется стремительным ухудшением плацентарного кровотока. Острая плацентарная недостаточность возникает в основном в результате отслойки плаценты или гибели отдельных участков ткани плаценты например при образовании тромбов в сосудах. Причиной отслойки может послужить травма живота, антифосфолипидный синдром.
Фосфолипиды – это сложные жиры, которые входят в состав оболочек всех клеток организма. В ряде случаев иммунная система организма вырабатывает большое количество антител к некоторым собственным фосфолипидам и белкам, связывающим эти липиды. Они называются антифосфолипидные антитела и при взаимодействии с клетками организма вызывают повреждение клеток и активацию свертывающей системы крови, что приводит к тромбообразованию.
Антифосфолипидный синдром является самой частой причиной тромботических осложнений при беременности, в том числе причиной отслойки плаценты и острой плацентаной недостаточности.
Вызвать отслойку плаценты может также тяжелое течение гестоза – грозного осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Острая плацентарная недостаточность развивается при отслойке более 2/3 поверхности плаценты.
В случае развития острой плацентарной недостаточности необходимо максимально быстро провести операцию кесарева сечения для сохранения жизни малыша и мамы.
Значительно чаще у беременных женщин встречается хроническая плацентарная недостаточность. В этом случае происходит нарушение формирования и созревания плаценты, уменьшается маточно-плацентарный и плодово-плацентарный кровотоки, ограничивается газообмен и обмен веществ в плаценте, снижается синтез плацентарных гормонов. Все эти изменения определяют недостаточное поступление кислорода и питательных веществ малышу, вызывают задержку роста и развития плода.
Причинами плацентарной недостаточности чаще всего являются перенесенные аборты, особенно хирургический аборт при первой беременности, курение, при этом количество и крепость выкуриваемых сигарет значения не имеют, поскольку на формировании неполноценных сосудов плаценты негативное действие оказывает табачный дым, а не никотин.
В группу риска по развитию плацентарной недостаточности входят также женщины с хроническими заболеваниями, такими как артериальная гипертензия, железодефицитная анемия, пиелонефрит, сахарный диабет, заболевания щитовидной железы.
В последние годы наблюдается значительный рост плацентарной недостаточности, вызванной бактериями, вирусами, грибами. Причиной этого может быть как острая инфекция, перенесенная будущей мамой во время беременности, так и активация хронического инфекционного процесса в организме беременной женщины.
Немаловажное значение в формировании хронической плацентарной недостаточности играет патология матки: эндометриоз, пороки развития матки (седловидная, двурогая). Фактором риска врачи считают также миому матки. Безусловно, целый ряд лекарственных средств оказывает неблагоприятное влияние на формирование плаценты и развитие плода. В настоящее время определен список препаратов, не разрешенных к применению во время беременности.
Фактором риска врачи считают также миому матки. Безусловно, целый ряд лекарственных средств оказывает неблагоприятное влияние на формирование плаценты и развитие плода. В настоящее время определен список препаратов, не разрешенных к применению во время беременности.
Также большое значение в развитии плацентарной недостаточности имеет тромбофилия – повышенная склонность организма к образованию сгустков крови – тромбов в сосудах.
В некоторых случаях плацентарная недостаточность может быть обусловлена наличием хромосомных нарушений у плода, в частности при синдромах Дауна (наличие дополнительной 21 хромосомы у плода) или синдроме Эдвардса (дополнительная 18 хромосома у плода) уже в ранние сроки беременности диагностируется нарушение функции плаценты.
Следует отметить, что среди осложнений беременности, наиболее часто приводящих к развитию хронической плацентарной недостаточности, существенным фактором является преэклампсия (или поздний гестоз) – это осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Независимо от факторов, способствующих развитию плацентарной недостаточности, в основе ее лежат нарушения кровообращения в маточно-плацентарном комплексе, приводящие к нарушению всех функций плаценты. Следовательно, симптомы хронической плацентарной недостаточности будут обусловлены недостатком поступления кислорода и питательных веществ к плоду.
Это прежде всего, задержка внутриутробного развития плода – отставание размеров плода и замедление темпов его роста. Часто имеют место изменение двигательной активности плода. Сначала может быть некоторое усиление движений, а затем уменьшение. Нарушение защитной функции плаценты приводит к внутриутробному инфицированию плода под действием проникающих через плаценту патогенных (болезнетворных) микроорганизмов. Плод, развитие которого происходит в условиях плацентарной недостаточности, в значительно большей степени подвержен риску травматизации в родах, у них отмечается нарушение адаптации к внеутробной жизни, повышенная заболеваемость в первый год жизни.
По времени возникновения врачи разделяют плацентарную недостаточность на раннюю и позднюю.
Ранняя (или первичная) плацентарная недостаточность развивается до 16 недель беременности. Она возникает уже на этапе формирования плаценты и связана с заболеваниями беременной женщины, имеющимися до беременности, к примеру с патологией матки, хронической артериальной гипертензией, эндокринологическими заболеваниями. При этом происходит формированием неполноценных сосудов в плаценте.
Поздняя (или вторичная) плацентарная недостаточность возникает после 16 недель беременности и чаще всего связана с заболеваниями, возникшими уже во время беременности. Чаще всего это железодефицитная анемия (то есть снижение концентрации гемоглобина и железа в крови), гестационный сахарный диабет (то есть нарушение усвоения организмом глюкозы, возникшее на фоне беременности), перенесенные вирусные и бактериальные инфекции.
Важным является подразделение плацентарной недостаточности на компенсированную и декомпенсированные формы. Компенсированная плацентарная недостаточность развивается, к примеру, при угрозе прерывания беременности и нетяжелых формах позднего гестоза, в случае, если эти осложнения успешно поддаются медикаментозной коррекции. Декомпенсированная плацентарная недостаточность вызывает развитие задержки развития плода, хронической внутриутробной гипоксии, вплоть до гибели плода.
Компенсированная плацентарная недостаточность развивается, к примеру, при угрозе прерывания беременности и нетяжелых формах позднего гестоза, в случае, если эти осложнения успешно поддаются медикаментозной коррекции. Декомпенсированная плацентарная недостаточность вызывает развитие задержки развития плода, хронической внутриутробной гипоксии, вплоть до гибели плода.
Диагностика плацентарной недостаточности
Лечить уже развившуюся плацентарную недостаточность практически невозможно, поэтому врачи активно стремятся выявлять беременных женщин, угрожаемых в отношении формирования нарушений функции плаценты. Если плацентарная недостаточность выявляется в 3 триместре беременности, эффективного лечения, к сожалению, не существует. Поэтому очень активно в настоящее время применяются все способы выявления в ранние сроки беременности тех женщин, в формировании плаценты которых произошли нарушения.
В первую очередь, при постановке на учет по беременности выявляют максимально значимые факторы риска – курение, перенесенные аборты, отягощенную наследственность (низкий вес при рождении, склонность к тромбозам), наличие хронических заболеваний сердца, сосудов, сахарного диабета.
Профилактические мероприятия против развития плацентарной недостаточности особенно актуальны и необходимы до 16-17 недель беременности, когда происходит формирование структур плаценты.
Значимую помощь в оценке риска развития плацентарной недостаточности оказывает пренатальный скрининг, который проводится в 11-14 недель беременности. Он проводится для выявления синдромов Дауна, Эдвардса и др. хромосомных болезней у плода. В настоящее время самым актуальным является проведение комплексного ранний скрининг беременной на прогнозирование риска развития плацентарной недостаточности, преэклампсии и внутриутробной задержки развития плода. Поскольку данный вид диагностики относится к самым современным и передовым, к сожалению, он пока не включен в перечень услуг, предоставляемых в женской консультации в рамках ОМС, но доступен всем желающим в центрах пренатальной диагностики.
Определение белков, вырабатываемых плацентой
В первую очередь проводят определение белка РАРР-А, он является также маркером хромосомных аномалий плода. Снижение концентрации РАРР-А в крови в 11-14 недель беременности встречается у беременных женщин, имеющих высокий риск плацентарной недостаточности и задержки развития плода.
Снижение концентрации РАРР-А в крови в 11-14 недель беременности встречается у беременных женщин, имеющих высокий риск плацентарной недостаточности и задержки развития плода.
Второй гормон плаценты, который помогает в оценке рисков плацентарной недостаточности – PIGF (плацентарный фактор роста). Его концентрация в крови снижается задолго до первых проявлений плацентарной недостаточности. Его определение применяют не настолько широко, как PAPP-A, но тем не менее многие лаборатории уже включили данный белок в пренатальный скрининг 1 триместра. Крайне важное значение при проведении скрининга 1 триместра имеет измерение кровотоков в сосудах матки. Однозначно доказано, что сужение сосудов матки, определяемое при исследовании, свидетельствует о неполноценности формирования плаценты, которое будет ухудшаться с увеличением срока беременности и приведет к снижению питания малыша и снабжения его кислородов, то есть к развитию плацентарной недостаточности и задержки развития плода. При нормальных размерах маточных сосудов в 11-14 недель беременности риск тяжелой плацентарной недостаточности ничтожно мал.
Следующее обязательное скрининговое ультразвуковое исследование проводится в 20-21 неделю беременности. При этом обязательно проводят измерения плода, чтобы оценить, нет ли отставания в росте. Ведь при кислородном голодании замедляются темпы роста плода и размеры его начинают отставать от нормы для каждого срока беременности. Кроме того врач обязательно оценивает состояние и зрелость плаценты. Во время УЗИ проводится также допплерометрия сосудов матки для выявления ранних изменений, предшествующих клиническим проявлениям плацентарной недостаточности.
У пациенток, относящихся к группе высокого риска кроме УЗИ и допплерометрии проводят также суточное мониторирование колебаний артериального давления, определение количества белка в анализе мочи, собранном за сутки, оценивают показатели системы свертывания крови.
Третье УЗИ проводится всем будущим мамам в 30–34 недели беременности. Врач измеряет окружность головы и живота крохи, длину костей его ручек и ножек, и вычисляет предполагаемый вес плода.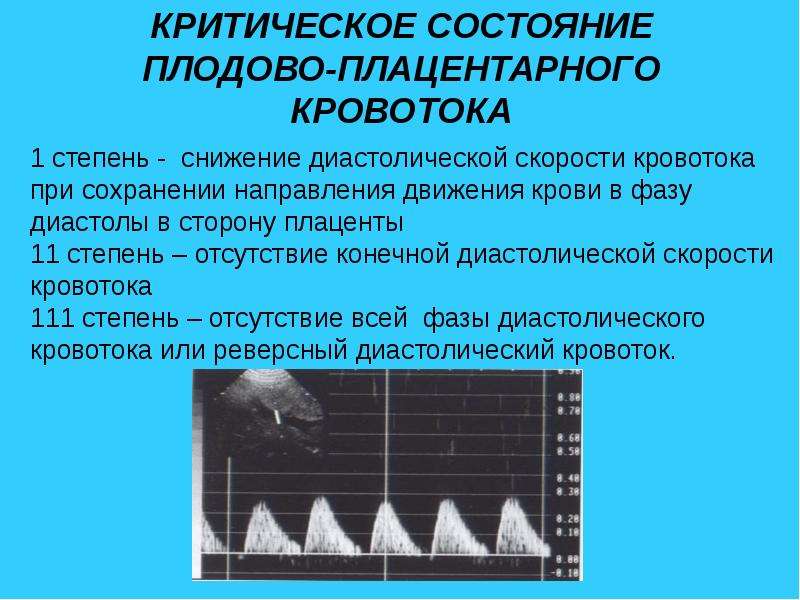 Эти измерения позволяют доктору убедиться в том, что малыш развивается нормально. Также имеет значение строение плаценты, наличие в ней признаков старения, вследствие чего она обычно перестает полноценно снабжать малыша кровью, а, значит, ему перестает хватать кислорода и питательных веществ и развитие ребенка нарушается. Во время УЗИ оценивается количество и вид околоплодных вод, которые также могут изменяться при внутриутробном страдании плода.
Эти измерения позволяют доктору убедиться в том, что малыш развивается нормально. Также имеет значение строение плаценты, наличие в ней признаков старения, вследствие чего она обычно перестает полноценно снабжать малыша кровью, а, значит, ему перестает хватать кислорода и питательных веществ и развитие ребенка нарушается. Во время УЗИ оценивается количество и вид околоплодных вод, которые также могут изменяться при внутриутробном страдании плода.
ДОППЛЕРОМЕТРИЯ
Допплерометрия сосудов плаценты и пуповины (метод исследования скоростей кровотоков в этих сосудах) так же позволяет оценить самочувствие малыша. Доктор исследует кровоток в артериях матки, пуповины, сердца и мозга ребенка. Это исследование позволяет определить, хорошо ли работает плацента, нет ли признаков нехватки кислорода у малыша, или развития гестоза у мамы. При снижении скорости кровотока в каком-либо сосуде можно говорить о нарушениях питания плода различной степени тяжести.
Вовремя проведенное обследование позволяет выявить начальные стадии дефицита кровоснабжения. В таких случаях лечение сможет предотвратить грозные осложнения, такие как гипоксия и внутриутробная задержка развития малыша. Допперометрию проводят в 20–21 неделю и в 30-32 недели беременности, при наличии изменений, контроль осуществляют минимум каждые две недели.
В таких случаях лечение сможет предотвратить грозные осложнения, такие как гипоксия и внутриутробная задержка развития малыша. Допперометрию проводят в 20–21 неделю и в 30-32 недели беременности, при наличии изменений, контроль осуществляют минимум каждые две недели.
КАРДИОТОКОГРАФИЯ
Это важный метод оценки состояния плода. Проводится КТГ при сроке беременности 33 недели и более, поскольку только на этом этапе внутриутробного развития малыша устанавливается полноценная регуляция деятельности сердечно-сосудистой системы плода центрами спинного и головного мозга. Запись сердцебиений плода проводят в течение 20–40 минут, а при необходимости исследование может быть продлено до 1,5 часов.
Аппарат регистрирует и записывает частоту сердцебиений малыша. Врач акушер-гинеколог оценивает кривую записи сердцебиений, эпизоды урежения и резкого учащения частоты сердечных сокращений плода и на основании этих данных делает заключение о том, насколько комфортно малыш чувствует себя в животе у мамы. К примеру, при снижении концентрации кислорода в крови плода, уменьшается и его поступление к клеткам нервной системы, что в свою очередь отражается на частоте сердечных сокращений. При нормальном течении беременности КТГ проводят после 33 недели 1 раз в 10–14 дней, иногда чаще. В некоторых клиниках в настоящее время предлагается услуга постоянного КТГ-мониторирования, что приобретает актуальность при наличии признаков плацентарной недостаточности. Беременной женщине выдается мониторчик, который регистрирует изменения сердечной деятельности малыша и эти данные по интернету передаются лечащему врачу.
К примеру, при снижении концентрации кислорода в крови плода, уменьшается и его поступление к клеткам нервной системы, что в свою очередь отражается на частоте сердечных сокращений. При нормальном течении беременности КТГ проводят после 33 недели 1 раз в 10–14 дней, иногда чаще. В некоторых клиниках в настоящее время предлагается услуга постоянного КТГ-мониторирования, что приобретает актуальность при наличии признаков плацентарной недостаточности. Беременной женщине выдается мониторчик, который регистрирует изменения сердечной деятельности малыша и эти данные по интернету передаются лечащему врачу.
Лечение плацентарной недостаточности
Специфических способов лечения плацентарной недостаточности в настоящее время не существует, поскольку нет лекарственных препаратов, которые избирательно улучшают маточно-плацентарный кровоток. Именно поэтому все меры борьбы с плацентарной недостаточностью направлены на профилактику. Если пациентка относится к группе высокого риска по развитию плацентарной недостаточности, с раннего срока беременности ей назначают лекарственные препараты, эффективность которых хорошо доказана и которые предупреждают раннее развитие выраженных нарушений функции плаценты.
Если во время проведения дополнительных методов оценки состояния плода выявляются начальные нарушения поступления кислорода к малышу, проводится медикаментозное лечение, направленное на увеличение притока крови и кислорода через плаценту и обязательные контрольные обследования на фоне проводимой терапии. Если изменения серьезные и малыш испытывает выраженный дефицит кислорода и питательных веществ, состояние его страдает, то в таких случаях проводится экстренное родоразрешение.
Сделать допплер УЗИ (допплерометрия плода) при беременности
Преимущества УЗИ исследования в Нова Клиник
Аппарат УЗИ экспертного уровня Voluson E8
Использование новейших технологий
Опытные УЗИ-специалисты
С целью наблюдения за развитием и общим состоянием плода во время беременности в определенные сроки (скрининговые) женщинам назначаются ультразвуковые исследования (УЗИ).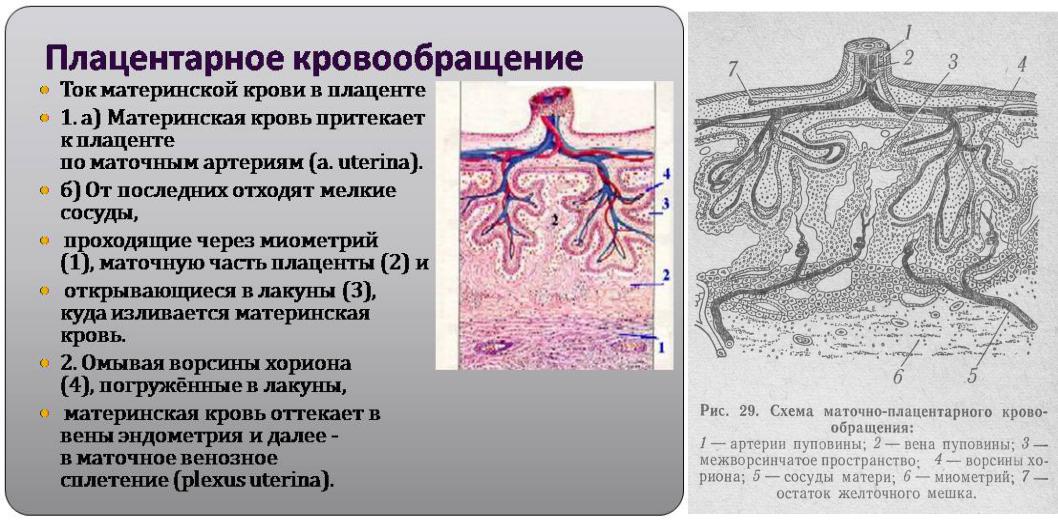 УЗИ при беременности включает в себя подробный осмотр внутренних органов плода, исключение наличия маркеров генетических заболеваний, определение пола и веса плода. Кроме того, в исследование обязательно входит осмотр плаценты, околоплодных вод, пуповины, а также стенок матки, длины цервикального канала и, по возможности, состояния яичников женщины.
УЗИ при беременности включает в себя подробный осмотр внутренних органов плода, исключение наличия маркеров генетических заболеваний, определение пола и веса плода. Кроме того, в исследование обязательно входит осмотр плаценты, околоплодных вод, пуповины, а также стенок матки, длины цервикального канала и, по возможности, состояния яичников женщины.
Допплеровское исследование – исследование кровотока в сосудах, которое проводится на аппарате УЗИ экспертного класса. По ощущениям женщины это исследование не отличается от обычного УЗИ.
Принцип работы УЗИ с допплером
Принцип работы допплера основан на отражении ультразвуковых волн от движущихся потоков крови. Эти сигналы улавливает и обрабатывает компьютер ультразвукового аппарата в виде цифровых значений, которые оцениваются врачом по нормативным таблицам, составленным согласно сроку беременности. На основании полученных данных специалист может дать заключение о том, как идет поток крови по сосудам (ламинарное или турбулентное течение крови), есть ли участки сужения (спазма) или, наоборот, расширения (при снижении тонуса стенок сосудов).
Для оценки состояния внутренних органов, особенно, сердца и крупных сосудов, используется дополнительно цветное допплеровское картирование (ЦДК), позволяющее исключать пороки развития сердечно-сосудистой системы, а также аномалии развития в системе кровоснабжения у плода.
При этом исследовании на мониторе ультразвукового аппарата выводится цветное изображение потока крови в кровеносном сосуде или камерах сердца плода, по которому оценивается направление тока крови, а также исключаются дефекты стенок и клапанов.
С 20-й недели беременности женщинам при наличие определенных показаний может проводится допплерометрия маточно-плацентарного и плодового кровотока для исключения нарушения кровообращения в системе мать-плацента-плод. В этот период могут быть выявлены как серьезные нарушения, требующие срочной госпитализации и лечения (а иногда, и экстренного родоразрешения), так и начальные, при которых должно назначается профилактическое лечение.
Многие пациенты интересуются, чем отличаются допплерометрия и допплерография. Нужно сказать, разницы практически нет: в первом случае оценка кровотока осуществляется врачом на основании показателей с монитора, во втором – производится их запись на бумажном носителе.
Хотите записаться на прием?
Показания для проведения допплерометрии
Показанием для исследования является высокий риск развития нарушения кровообращения в сосудах матки, плаценты, пуповины, а так же крупных сосудах плода. Целью исследования является раннее выявление гипоксии (кислородного голодания) плода у женщин с высоким риском развития различной патологии во время беременности. Допплерометрия маточно-плацентарного и плодового кровотока проводится в следующих случаях:
- беременным женщинам из групп высокого риска по развитию гестоза (токсикоза) второй половины беременности, всем беременным женщинам после после ЭКО, в возрасте старше 34 лет и юным беременным, а так же женщинам, входящим в группы риска по развитию гестационного пиелонефрита и сахарного диабета.

- беременным с различной соматической (общетерапевтической) патологией: сердечно-сосудистой системы (в том числе с артериальной гипертензией), почек, печени, щитовидной железы, дыхательной системы и т.п.;
- беременным с высоким риском развития конфликта по системе АВО и резус фактору;
- беременным женщинам с отягощенным акушерско-гинекологическом анамнезе: бесплодием, невынашиванием, антенатальной гибелью плода и т.д.;
- при многоплодной беременности;
- при подозрении на задержку внутриутробного развития плода, а так же неудовлетворительных показателях кардиотокографии (КТГ).
- курящим, а также женщинам, употребляющим алкоголь, наркотики
- при острых акушерских ситуациях, требующих немедленного принятия решения о тактике ведения беременной женщины (например, при преэклампсия, кровянистых выделениях из половых путей во 2-й половине беременности, сильных болях в животе, подозрении на отслойку плаценты, редких шевелениях плода, преждевременном излитии околоплодных вод и т.
 д.)
д.)
Кроме того, при нормально протекающей беременности желательно делать допплерометрию дважды – на сроках 30 недель и 35-36 недель беременности.
Основная цель допплерометрии – оценка кровообращения в системе мать-плацента-плод при исследовании кровотока в следующих сосудах: маточных артериях (правой и левой), артериях и вене пуповины (в норме пуповина состоит из двух артерий и одной вены), а также в средней мозговой артерии плода. Кроме того, в некоторых случаях становится необходимым исследование кровотока в аорте, венозном протоке, сонных артериях плода и некоторых других сосудах.
В ходе исследования компьютер аппарата выводит на экран так называемые индексы периферического сосудистого сопротивления (индекс резистентности и пульсационный индекс), скорости кровотока в сосудах и другие показатели адекватности движения крови по сосудам.
Подготовка к процедуре
Для проведения допплерометрии во время беременности специальной подготовки не требуется. Поэтому женщине нет необходимости беспокоиться о соблюдении каких бы то ни было ограничений накануне или в день процедуры. Будущей маме нужно только записаться на прием и в назначенное время подъехать в клинику.
Поэтому женщине нет необходимости беспокоиться о соблюдении каких бы то ни было ограничений накануне или в день процедуры. Будущей маме нужно только записаться на прием и в назначенное время подъехать в клинику.
Степени тяжести нарушения маточно-плацентарного кровотока
Для определения степени нарушения маточно-плацентарного и плодового кровотока имеется классификация, созданная под редакцией проф. М.В.Медведева, которая позволяет судить о степени тяжести нарушения кровотока. Согласно классификации выделяют три степени нарушения МППК:
- 1 степень (начальные нарушения МППК)
- 2 степень (гемодинамические нарушения, не достигающие критических значений, но требующие лекарственной коррекции)
- 3 степень (критические нарушения кровотока, свидетельствующие о внутриутробном страдании плода)
Вне зависимости от показателей маточно-плацентарного и плодово-плацентарного кровотока, необходимо также оценить плодовый кровоток. Оценка скорости кровотока и сосудистого сопротивления в средней мозговой артерии отражает наличие или отсутствие кислородного голодания плода (гипоксии), а также поможет исключить анемию у плода при развитии иммуногематологического конфликта по системе АВО или резус-фактору. При оценке плодового кровотока тоже выделяют три степени нарушений:
Оценка скорости кровотока и сосудистого сопротивления в средней мозговой артерии отражает наличие или отсутствие кислородного голодания плода (гипоксии), а также поможет исключить анемию у плода при развитии иммуногематологического конфликта по системе АВО или резус-фактору. При оценке плодового кровотока тоже выделяют три степени нарушений:
- 1 степень – начальные изменения, т.е.обратимые при назначении своевременного лечения
- 2 степень – признаки внутриутробной гипоксии, требующие интенсивной терапии, возможно, экстренного родоразрешения
- 3 степени – признаки тяжелой гипоксии, требующие немедленного принятия решения об экстренном родоразрешении
В настоящее время, когда беременные женщины находятся под постоянным и пристальным контролем врачей акушеров-гинекологов, критические нарушения маточно-плацентарного и плодового кровотока, благодаря мерам профилактики и выявлению изменений со стороны кровотока на начальных этапах, регистрируются очень редко.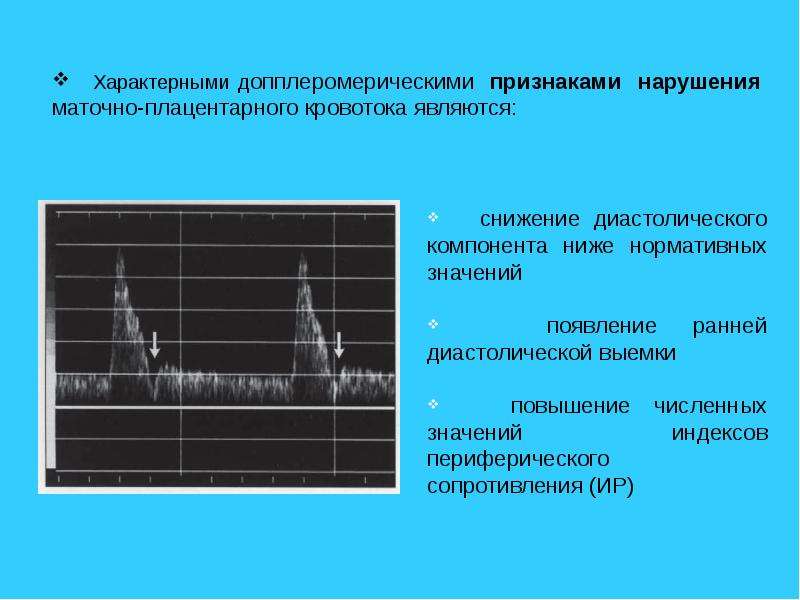 Как правило, тяжелые изменения МППК регистрируются у плодов с генетической (хромосомной, генной) патологией, что является основанием для медико-генетического консультирования.
Как правило, тяжелые изменения МППК регистрируются у плодов с генетической (хромосомной, генной) патологией, что является основанием для медико-генетического консультирования.
Следует также понимать, что женщины, входящие в группы высокого риска по различным патологиям беременности, должны сами ответственно относиться к своему здоровью, вести здоровый образ жизни и своевременно посещать своего врача. Только это дает все шансы на рождение здорового доношенного ребенка.
Стоимость допплерографии в Нова Клиник вы можете увидеть в таблице ниже или в разделе “Цены”.
Остались вопросы?
Допплерометрия (УЗИ с допплером) – цены в Москве
Способ лечения плацентарной недостаточности у беременных с вагинальными дисбиозами
Изобретение относится к медицине, а именно к разделу акушерство, и касается лечения плацентарной недостаточности. Известен способ комплексного лечение пациенток с фето-плацентарной недостаточностью проводилось на фоне традиционной, а так же современной лазерной терапии под контролем показателей УЗИ, допплеровского исследования, кардиотокографии плода (Демидов В.Н. «Значение автоматизированной антенатальной кардиотокографии в снижении перинатальной смертности» // В.Н. Демидов, И.К. Сигизбаева, О.Ю. Огай // III Международный конгресс по репродуктивной медицине: Материалы конгр. – М., 2009. С. 36-37; Воскресенский, С.Л. Оценка состояния плода. Кардиотокография. Доплерометрия. Биофизический профиль // Учебное пособие. М., 2004. – С. 304).
Известен способ комплексного лечение пациенток с фето-плацентарной недостаточностью проводилось на фоне традиционной, а так же современной лазерной терапии под контролем показателей УЗИ, допплеровского исследования, кардиотокографии плода (Демидов В.Н. «Значение автоматизированной антенатальной кардиотокографии в снижении перинатальной смертности» // В.Н. Демидов, И.К. Сигизбаева, О.Ю. Огай // III Международный конгресс по репродуктивной медицине: Материалы конгр. – М., 2009. С. 36-37; Воскресенский, С.Л. Оценка состояния плода. Кардиотокография. Доплерометрия. Биофизический профиль // Учебное пособие. М., 2004. – С. 304).
Недостатком способа является отсутствие взаимосвязи предложенной схемы лечения плацентарной недостаточности в зависимости от индивидуального сочетания этиологических факторов и патогенетических механизмов развития данного осложнения.
В последние годы разработаны и продолжают совершенствоваться различные методы лечения плацентарной недостаточности, однако проблема далека от своего разрешения.
Известен способ лечения фето-плацентарной недостаточности с дисбиотическими нарушениями влагалища биологически активной добавкой (БАД), содержащей Spirulina platensis, приводящий к восстановлению нарушений в системе мать-плацента-плод, усилению процессов оксигенации в организме матери, интенсификации трофических процессов у плода, улучшению его функционального состояния. Данный способ лечения способствует продлению гестационного возраста плода при угрозе преждевременных родов, увеличению массо-ростовых показателей новорожденных. Указанные свойства Spirulina platensis дают основание предполагать, что включение данной биологически активной добавки в комплекс лечения беременных с дисбиотическими нарушениями влагалища позволит повысить адаптационные возможности плода. Принимать по 1 капсуле 3 раза в день перед едой.
Недостатком данного способа является, повышенная чувствительность компонентов препарата, заболевания желудочно-кишечного тракта, диарея, головная боль, головокружение. (Куркин В.А., Радзинский В.Е., Захарова К.А. «Современные аспекты химической классификации биологически активных соединений лекарственных растений // Фармация, 2002 – №2. – С. 8-16; Радзинский В.Е. «Лекарственные растения и биологически активные добавки в акушерстве и гинекологии // Под редакцией В.Е. Радзинского, 2009, с. 215.).
(Куркин В.А., Радзинский В.Е., Захарова К.А. «Современные аспекты химической классификации биологически активных соединений лекарственных растений // Фармация, 2002 – №2. – С. 8-16; Радзинский В.Е. «Лекарственные растения и биологически активные добавки в акушерстве и гинекологии // Под редакцией В.Е. Радзинского, 2009, с. 215.).
Также известен способ лечения плацентарной недостаточности с использованием лазерной и медикаментозной терапии, где с помощью лазерной установки генерировалось импульсное низкоинтенсивное лазерное излучение длиной волны 780 нм, средней мощностью импульсов 2,5 мВт, частотой следования импульсов от 50 до 100 Гц. Облучение производили на область проекции петель пуповины на переднюю брюшную стенку беременной женщины, продолжительностью 4-5 минут. (Тулупова М.С.«Состояние плодов, новорожденных, родившихся от матерей с фетоплацентарной недостаточностью и в зависимости от способа родоразрешения». – Дис. кандидата мед. наук; Москва, 2002 г., С. 25.)
Однако недостатком данного способа является необходимость знания точного места проекции петель пуповины на брюшную стенку, что является невозможным без предварительного УЗИ, отсутствия патогенетической обусловленности при назначении лазеротерапии, а так же нет дифференцированного подхода при назначении НИЛИ (низкоинтенсивное лазерное излучение).
Наиболее близким к заявленному изобретению является способ лечения плацентарной недостаточности, включающий одновременно медикаментозную и лазерную терапию. Используют контактно-стабильную методику. Длина волны составляет 0,89 мкм, импульсный режим, частота следования импульсов 80 Гц. При задержке внутриутробного развития плода на 1 неделю, нарушении маточно-плацентарного кровотока 1а степени, показателе плода 1,1-1,5 ежедневно проводят чрескожное воздействие на область локтевой вены с использованием контактно-стабильной методики, мощностью 55 Вт, продолжительностью 4 минуты, курсом 5 процедур; при задержке внутриутробного развития плода на 2 недели, нарушении маточно-плацентарного кровотока 16 степени, показателе состояния плода 1,5-2 проводят чрескожное воздействие на область локтевой вены. Мощность 60 Вт, продолжительность 5 мин, курсом 7 процедур. При задержке внутриутробного развития на 3 недели, нарушении маточно-плацентарного кровотока 2 степени, показателе плода больше 2 проводят чрескожное воздействие на переднюю брюшную стенку на область проекции плаценты. Мощность 65 Вт, продолжительность 6 минут, ежедневным курсом 10 процедур. (Патент №2456031. Способ лечения плацентарной недостаточности. Найфонова А.Н., Цаллагова Л.В., Лазарев В.В.)
Недостатком данного способа является его недостаточная эффективность при лечении беременных с фетоплацентарной недостаточностью.
Так же в настоящее время в литературе неизвестны способы одновременного лечения беременных с фетоплацентарной недостаточностью и бактериальным вагинозом.
Цель изобретения: создание эффективного способа лечения плацентарной недостаточности у беременных с вагинальными дисбиозами. Поставленная цель достигается путем лазерного облучения, с помощью которого беременным ежедневно проводили чрескожное воздействие на локтевую вену. Также, параллельно проводилась санация влагалища раствором мирамистин 0,01% в течении 5 минут, а затем введение 1 таблетки Флуомизина на ночь курсом 6 дней.
Оптимальную дозу лазерного облучения подбирали исходя из показателей УЗИ, допплерографического исследования и кардиотокографии плода. При нарушении маточно-плацентарного кровотока 1а степени, задержке внутриутробного развития плода на 1 неделю, сумме показателей по Фишер 7 баллов, ежедневно проводили чрескожное воздействие на область локтевой вены длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительность 2 минуты, курсом 5 процедур.
При нарушении маточно-плацентарного кровотока 16, задержке внутриутробного развития на 2 недели и сумме показателей по Фишер 6-7 баллов, ежедневно проводили чрескожное облучение на область локтевой вены лазерным аппаратом длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительность 5 минут, ежедневным курсом 7 процедур.
При нарушении маточно-плацентарного кровотока 2 степени, задержке внутриутробного развития плода на 3 недели, оценка плода по Фишер 6 баллов ежедневно проводили чрескожное облучение на переднюю брюшную стенку на область проекции плаценты. Длина волны 905 нм, частота 1000 Гц, мощность 65 Вт, продолжительность 6 минут, ежедневным курсом 10 процедур.
С целью коррекции вагинальных дисбиозов беременным проводилась санация влагалища раствором Мирамистин 0,01% в течении 5 минут, с последующим введением таблетки Флуомизин на ночь в течении 6 суток.
Предлагаемый метод лечения беременных с плацентарной недостаточностью на фоне вагинальных дисбиозов использовался у 110 женщин в возрасте 18-42 года, из них 60 пациенток составили основную и 50 контрольную группы. В первой основной группе традиционное лечение фетоплацентарной недостаточности дополнялось применением лазерной терапии при помощи лазерного аппарата. Пациентки контрольной группы получали стандартную терапию фетоплацентарных нарушений. Обе группы на втором этапе лечения получали «Ацилакт» по 1 свече вагинально на ночь, в течение 7 дней. Комплексное исследование эффективности различных способов лечения фетоплацентарной недостаточности у беременных с бактериальным вагинозом отображено на табл. 1.
Таким образом, полученные данные показателей биофизического профиля плода свидетельствуют, что лучшие результаты достигнуты у беременных основной группы, получавших лазерную терапию.
Проведенное допплерометрическое исследование фето-плацентарного комплекса выявило достоверное уменьшение показателей систолодиастолического отношения (СДО), пульсационного индекса (ПИ) и индекса резистентности (ИР) в маточных артериях и артериях пуповины, что свидетельствовало об улучшении маточно-плацентарного и плодово-плацентарного кровотока (табл. 2 и 3).
В качестве иллюстрации приводим краткие примеры.
Пример 1
Беременная Е., 28 лет
Жалобы на тянущие боли внизу живота, повышенную двигательную активность плода. Обильные выделения из влагалища, зуд, появившиеся около двух недель назад.
Анамнез: менструации с 16 лет, по 4-5 дней, через 28-30 дней, регулярные, умеренные, безболезненные.
Половая жизнь с 23 лет.
Первая беременность завершилась преждевременными родами в сроке 30 недель, гибелью плода.
Настоящая беременность II, роды предстоят первые.
Данная беременность протекала в первой половине на фоне угрозы прерывания, по поводу чего находилась на стационарном лечении в сроке 10-11 недель.
Объективно: среднего телосложения, умеренного питания. Общее состояние удовлетворительное, АД-100/70 мм рт.ст., ps 79 уд. в мин. Живот овоидной формы, увеличен за счет беременности. Матка возбудима при пальпации. Положение плода продольное, предлежит головка над входом в малый таз. Сердцебиение плода несколько приглушено, ритмичное 140 уд. в мин. Воды целы. Отеков нет. Физиологические оправления в норме. Высота стояния дна матки 32. Окружность живота 102 см.
Гинекологический статус: НПО развиты правильно, гиперемированы; оволосение по женскому типу.
В зеркалах: шейка матки синюшного цвета. Наружный зев закрыт. Выделения бели, обильные.
Обследована: 17.03.15 г. Микроскопическое исследование содержимого влагалища (наличие ключевых клеток, лейкоциты до 10 ед. в поле зрения), бактериологическое исследование (дрожжеподобные грибы, гарднереллы), доплерометрия (нарушение маточно-плацентарного и плодово-плацентарного кровотока 2-й А степени), кардиотокографическое исследование (задержка внутриутробного развития плода на 2 недели, по Фишеру 6-7 баллов).
Диагноз: Беременность 33 недели. Головное предлежание. Угроза преждевременных родов. Фетоплацентарная недостаточность II ст. ЗВУР плода. ОАА (антенатальная гибель плода). Рубец на матке.
Назначено лечение:
– диета, богатая белком и витаминами;
– раствор глюкозы 40% – 10,0 с раствором аскорбиновой кислоты 5% – 5,0 в/в ежедневно №10-15;
– ацилакт свечи по 1 на ночь вагинально в течение 7 дней
– эссенциале 5,0 в/в в течение 10 дней;
– трентал 5,0 глюкоза 5%-400,0 в/в капельно ежедневно или через день №5;
– кокарбоксилаза 100 мг в/в струйно;
– актовегин 5,0 на 200,0 – 10% р-ра глюкозы в/в капельно №5;
– пирацетам 10,0 в/в, №10.
Медикаментозная терапия, включающая в себя: коррекцию фетоплацентарного нарушения, параллельно проводилась санация влагалища раствором мирамистин 0,01%, в течении 5 минут, а затем введение 1 таблетки Флуомизина на ночь курсом 6 дней.
В сочетании с чрескожным лазерным облучением на переднюю брюшную стенку на область проекции плаценты, мощностью 65 Вт, продолжительностью 6 мин, ежедневным курсом 10 процедур.
Лечение проводилось под ежедневным контролем АД и КТГ плода, а также доплерометрии.
Контроль:
Жалоб нет. Состояние удовлетворительное. Матка в нормальном тонусе. Сердцебиение плода ясное ритмичное, 140 уд. в мин.
На 10 сутки проведена микроскопия влагалищного содержимого лейкоцитов – 0.
Бактериологическое исследование дрожжевые клетки единичные, флора – палочки.
Через 2 недели произведена контрольная доплерометрия: нарушение плодово-плацентарного кровотока 16 степени.
И КТГ: признаки нарушения состояния плода (7-8 баллов по Фишеру).
Пример 2
Беременная М., 20 лет
Жалобы: на тянущие боли внизу живота, повышенный тонус матки, дискомфорт во влагалище.
Анамнез: менструации с 14 лет, по 3 дня, через 28 дней, регулярные, умеренные, безболезненные. Половая жизнь с 17 лет.
Гинекологический статус: кольпит.
Беременность первая, роды предстоящие.
В возрасте трех лет оперирована по поводу ранения органов брюшной полости.
Объективно: Общее состояние удовлетворительное, кожа и видимые слизистые чистые. АД 100/70 мм рт.ст., пульс – 78 уд. в мин. Живот продольной формы, увеличен за счет беременности. Высота стояния дна матки 36 см. Матка в нормальном тонусе. Сердцебиение плода несколько приглушено, ритмичное 140 уд. в мин. Воды целы. Отеков нет. Стул и диурез в норме. Молочные железы мягкие, безболезненные при пальпации.
В зеркалах: Наружные половые органы развиты правильно, шейка матки и стенки влагалища гиперемированы, выделения из влагалища белые. Аминотест положительный
Обследована: Микроскопическое исследование содержимого влагалища (наличие ключевых клеток, лейкоциты 15 ед. в поле зрения), бактериологическое исследование (дрожжеподобные грибы, гарднереллы, уреаплазма), допплерометрия (нарушение маточно-плацентарного и плодово-плацентарного кровотока 1-й А степени), кардиотокографическое исследование (задержка внутриутробного развития плода на 1 недели, по Фишеру 7-8 баллов).
Диагноз: Беременность 35 недель. Головное предлежание. Угроза преждевременных родов. Плацентарное нарушение кровотока, компенсированная форма. Признаки гипоксии плода. Преждевременное созревание плаценты. ЗВУР плода II ст. Гестационный пиелонефрит, ремиссия.
Назначено лечение:
– диета, богатая белком и витаминами;
– раствор глюкозы 40% – 10,0 с раствором аскорбиновой кислоты 5% – 5,0 в/в ежедневно №10-15;
– эссенциале 5,0 в/в в течение 10 дней;
– трентал 5,0 глюкоза 5%-400,0 в/в капельно ежедневно или через день №5;
– кокарбоксилаза 100 мг в/в струйно;
– актовегин 5,0 на 200,0 – 10% р-ра глюкозы в/в капельно №5;
– ацилакт свечи по 1 на ночь вагинально в течение 7 дней
– лазерное облучение крови на область локтевой вены курсом 5 процедур по 2 минуты (мощность излучения 50 Вт, длина волны 905 нм, частота 1000 Гц).
Пример 3
Беременная З., 23 года
Жалобы: на повышенный тонус матки, повышенную активность плода.
Анамнез: менструации с 13 лет, по 3-4 дня, через 28 дней, регулярные, умеренные, безболезненные. Половая жизнь с 20 лет.
Гинекологический статус: беременность 3, роды 3. Истмико-цервикальная недостаточность. Хирургическая коррекция шейки матки.
Первая беременность (2011 г.) завершилась в 24 недели отслойкой плаценты. Преждевременные роды. Вторая беременность (2012 г.) Преждевременные роды в 28 недель. Плод (1650), умер на 13 сутки.
Беременная в сроке в 8-9 недель находилась на стационарном лечении с диагнозом «угроза прерывания беременности». В сроке 15-16 недель выполнена хирургическая коррекция шейки матки.
Из соматических заболеваний отмечает ОРВИ, ветряную оспу.
Объективно: общее состояние удовлетворительное, кожа и видимые слизистые чистые, АД 120/70 мм рт.ст., пульс – 82 уд. в мин. Молочные железы мягкие, безболезненные при пальпации.
Живот продольной формы, увеличен за счет беременности. Высота стояния дна матки 38 см. Матка в нормальном тонусе. Сердцебиение плода несколько приглушено, ритмичное 140 уд. в мин. Воды целы. Отеков нет. Стул и диурез в норме.
В зеркалах: Наружные половые органы развиты правильно, шейка матки цилиндрической формы, бледно-розовой окраски. Стенки влагалища без особенностей. Выделения молочного цвета, обильные, с «рыбным запахом». Аминотест положительный.
Обследована: Микроскопическое исследование содержимого влагалища (наличие ключевых клеток, лейкоциты 24 ед. в поле зрения), бактериологическое исследование (дрожжеподобные грибы, гарднереллы), допплерометрия (нарушение маточно-плацентарного и плодово-плацентарного кровотока 1-й В степени), кардиотокографическое исследование (задержка внутриутробного развития плода на 2 недели, по Фишеру 7 баллов).
Диагноз: Беременность 35-36 недель. Головное предлежание. Угроза преждевременных родов. Фетоплацентарная недостаточность, компенсированная форма. Признаки гипоксии плода. Истмико-цервикальная недостаточность. Хирургическая коррекция шейки матки. Анемия, осложненная беременностью. Варикозная болезнь.
Назначено лечение:
– диета, богатая белком и витаминами;
– раствор глюкозы 40% – 10,0 с раствором аскорбиновой кислоты 5% – 5,0 в/в ежедневно №10-15;
– эссенциале 5,0 в/в в течение 10 дней;
– трентал 5,0 глюкоза 5%-400,0 в/в капельно ежедневно или через день №5;
– кокарбоксилаза 100 мг в/в струйно;
– актовегин 5,0 на 200,0 – 10% р-ра глюкозы в/в капельно №5;
– пирацетам 10,0 в/в, №10;
– мальтофер 1 таблетка во время еды;
– ацилакт свечи по 1 на ночь вагинально в течение 7 дней
– лазерное облучение крови на область локтевой вены курсом 5 процедур по 2 минуты (мощность излучения 50 Вт, длина волны 905 нм, частота 1000 Гц).
28.03.2015 г. беременность завершилась срочными родами. Родился плод весом 3600 кг, ростом 52 см, оценка по Апгар 8-8 баллов.
Медико-социальная эффективность
Данный метод комплексной терапии фетоплацентарной недостаточности с применением лазерной терапии приводит к более эффективному лечению данной патологии у беременных, а также к сокращению койко-дней (7 дней). Кроме того, немаловажным фактором является снижение лекарственной нагрузки на организм беременной.
Способ лечения плацентарной недостаточности у беременных с вагинальными дисбиозами, включающий одновременное применение комплексной медикаментозной и лазерной терапии, отличающийся тем, что в течение 6 суток беременным ежедневно проводят санацию влагалища 0,01% раствором Мирамистина в течение 5 минут, с последующим введением таблетки Флуомизина на ночь, причем оптимальную дозу лазерного облучения подбирают исходя из показателей ультразвукового исследования, доплерографического исследования и кардиотокографии плода: при нарушении маточно-плацентарного кровотока 1а степени, задержке внутриутробного развития плода на 1 неделю, сумме показателей по Фишер 7 баллов ежедневно проводят чрескожное облучение на область локтевой вены длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительностью 2 минуты, курсом 5 процедур; при нарушении маточно-плацентарного кровотока 16, задержке внутриутробного развития на 2 недели и сумме показателей по Фишер 6-7 баллов ежедневно проводят чрескожное облучение на область локтевой вены лазерным аппаратом длиной волны 905 нм, частотой 1000 Гц, мощностью излучения 50 Вт, продолжительностью 5 минут, ежедневным курсом 7 процедур; при нарушении маточно-плацентарного кровотока 2 степени, задержке внутриутробного развития плода на 3 недели, оценке плода по Фишер 6 баллов ежедневно проводят чрескожное облучение на переднюю брюшную стенку на область проекции плаценты длиной волны 905 нм, частотой 1000 Гц, мощностью 65 Вт, продолжительностью 6 минут, ежедневным курсом 10 процедур.Фетоплацентарная недостаточность.
Всем известно, что ребёнок в утробе живёт за счёт плаценты. Это уникальный орган, формирующийся в организме беременной женщины и обеспечивает плода газообменом (доставляет кислород из крови мамы через маточно-плацентарную-плодовую систему и выводит углекислый газ маме же обратно в кровь), производит доставку питательных веществ, необходимых для его жизнедеятельности, роста и развития, осуществляет синтез гормонов, необходимых для поддержания беременности — прогестерон, ХГЧ, эстрогены и пр., защищает плода от воздействия вредных веществ, так или иначе попавших в организм будущей мамы. Однако, эта функция ограничена и пропускает многие лекарственные препараты, алкоголь и никотин. Иными словами, малыш не может существовать в утробе без плаценты. Естественно, что любые отклонения в работе этого органа ведут к серьёзным нарушениям в развитии плода. В этом случае говорят о фетоплацентарной недостаточности, когда нарушается кровообращение и рушится связь мать — плацента — плод.
Фетоплацентарная недостаточность (ФПН) — одно из наиболее часто встречающихся осложнений беременности. У 50-77% беременных женщин она становится основной причиной невынашивания, у 32% — возникает вследствие гестоза, в 25-45% случаев развивается при наличии экстрагенитальной патологии, после перенесенной вирусной или бактериальной инфекции проявляется более чем в 60% наблюдений.
Фетоплацентарная недостаточность, или плацентарная недостаточность (ПН), характеризуется морфологическими (строение), а также функциональными нарушениями в плаценте, прогрессирование которых может привести к гипоксии, задержке развития и даже к антенатальной гибели плода.
По времени и механизму возникновения различают два вида ПН:
- Первичная (до 16 недель), связана с нарушением процессов плацентации и имплантации;
- Вторичная (после 16 недель), развивается под влиянием внешних факторов, воздействующих на плод и/или мать, в уже сформированной плаценте.
По клиническому течению ПН выделяют:
- Острая – чаще всего возникает на фоне отслойки низко или нормально расположенной плаценты. Острая ПН происходит преимущественно в родах, однако не исключается ее возникновение на любом сроке гестации;
- Хроническая – возникает в различные сроки беременности. В свою очередь ее подразделяют на:
Компенсированную форму ПН – при которой нарушаются метаболические процессы в плаценте, но кровообращение в системе «мать-плацента-плод» не нарушено. За счет компенсаторных возможностей материнского организма, плод к этим изменениям приспосабливается и не испытывает дискомфорта;
Субкомпенсированную форму ПН – в случае если причины возникновения ПН не были устранены, компенсаторные механизмы организма испытывают нагрузку и постепенно начинают истощаться, достигая следующей стадии;
Декомпенсированную форму ПН – прогрессирование патологического процесса приводит к возникновению гемодинамических нарушений в системе «мать-плацента-плод» на уровне плодово-плацентарного и/или маточно-плацентарного кровообращения.
При использовании метода допплерометрии определяют 3 степени декомпенсированной формы ФПН:
- I степень
- ФПН Iа степени – нарушение гемодинамики происходит только в маточно-плацентарном кровотоке;
- ФПН Iб степени – нарушение возникает только плодово–плацентарном кровотоке;
- II степень – происходит нарушение кровотока на двух уровнях, но они не достигают критических значений;
- III степень – уровень нарушений в плодово–плацентарном кровотоке критический, жизнь плода под угрозой.
- Причины
Фетоплацентарная недостаточность ФПН встречается у будущих мам довольно часто, и неудивительно: причин, вызывающих её можно назвать весьма много.
- Патологии гипоталамуса и надпочечников, болезни щитовидной железы, диабет, астма, болезни почек, пороки сердца, артериальная гипертония — всё это может быть привести к развитию ФПН у будущих мам.
- Анемия говорит о дефиците железа в материнско-плодовом кровотоке, и ФПН может развиться как следствие. Проблемы со свёртываемостью крови могут спровоцировать появление тромбов в сосудах плаценты и нарушить плодово-плацентарный кровоток.
- Инфекции, обостряющиеся во время беременности, легко могут спровоцировать ФПН, поскольку вирусы и бактерии способны нанести повреждения плаценте. На ранних сроках беременности очевидным последствием может быть выкидыш, а начиная со второго триместра последствия будут зависеть от причины, вызвавшей ФПН и от особенностей её течения.
- Патологии матки могут вызвать ФПН, например, миометрия или эндометриоз. Миома также является фактором риска, в частности, у первородящих женщин от 35 лет.
- Преэкламсия, беременность более чем одним малышом, предлежание плаценты, тазовое предлежание плода, резус-конфликт — всё это так же с лёгкостью может вызвать появление ФПН.
Если большинство факторов, способных спровоцировать появление ФПН не зависит от самой будущей мамы, то следует знать о том меньшинстве, на которое повлиять возможно. Аборты в прошлом, курение, наркотики или алкоголь — всё это также относится к факторам риска, и развитие ФПН — лишь один из возможных поворотов событий.
Симптомы
Симптомы фетоплацентарной недостаточности начинают проявляться лишь при декомпенсированной форме ПН. Однако поначалу беременная может предъявлять лишь жалобы, характерные для экстрагенитальных и акушерских заболеваний, на фоне которых развивается ФПН, например, головная боль при гипертензии или отеки при преэкламсии. Но параллельно с этим, она может отметить, что число шевелений плода уменьшилось. Помните, что регулярные, но при этом не слишком частые шевеления плода – важный признак его состояния!
В случае если при ПН происходит внутриутробная задержка развития плода, то отмечается некоторое несоответствие высоты стояния дна матки к срокам гестации (косвенный признак), которое может быть выявлено при очередном посещении врача женской консультации.
Появление кровянистых выделений из влагалища на разных сроках беременности – опасный симптом. Он говорит о том, что произошла преждевременная отслойка плаценты, которая может привести к острой ФПН и гипоксии плода. В этом случае лучше немедленно обратиться за медицинской помощью!
Диагностика
Особое внимание необходимо уделять женщинам, входящим в группу риска по развитию ФПН. Таким беременным требуется в регулярное клиническое наблюдение. При каждом акушерском осмотре врач должен обращать внимание на прибавку в весе, измерять высоту стояния дна матки (ВДМ) и окружность живота. Несоответствие разности численного значения срока беременности и ВДМ, уменьшение числа шевелений, изменение частоты и глухость тонов сердцебиения плода является сигналом для проведения дополнительных исследований.
Определить ФПН можно при помощи 3-х основных методов:
- Ультразвуковое исследование. Этот метод позволяет оценить состояние плаценты (толщину, расположение, степень зрелости и т.д.) и плода (размеры, наличие пороков развития, соответствие темпов роста сроку гестации), а так же измерить количество околоплодных вод;
- Допплерометрия. С помощью данного метода диагностики исследуется кровоток в различных сосудах матери и плода, что позволяет точнее установить степень и уровень нарушений в системе мать-плацента-плод, а также позволяет подобрать рациональную терапию;
- Кардиотокография. Исследование, позволяющее оценить сердечную деятельность плода и косвенно судить о его состоянии.
Своевременная диагностика ФПН помогает вовремя распознать и отреагировать адекватным лечением на отклонения в развитии плода и течении беременности.
Лечение
При компенсированной форме ФПН допускается амбулаторное лечение при условии постоянного наблюдения (увеличивается число посещений в женскую консультацию). В остальных случаях необходима госпитализация. К сожалению, все существующие способы лечения не позволяют полностью восстановить нормальные функции и строение плаценты. Они лишь способствуют стабилизации процесса и предотвращают дальнейшее его прогрессирование.
Поскольку основной причиной развития данной патологии является нарушение кровообращения в сосудах, то все действия должны быть направлены на их устранения.
Все лечебные мероприятия проводятся исключительно в стационаре, под строгим наблюдением врачей и постоянным контролем допплерометрии, УЗИ и КТГ, в течение не менее 2-х недель.
Риски и последствия
Фетоплацентарная недостаточность при беременности часто приводит к следующим осложнениям:
- Прерыванию беременности;
- Гипоксии плода;
- Задержке развития и роста плода;
- Возникает риск антенатальной (внутриутробной) гибели плода.
ВАЖНО!!! Наличие ФПН при беременности еще не означает, что ребенок родится с ЗРП или раньше срока. При небольшой степени гемодинамических нарушений в системе мать-плацента-плод, раннем выявлении и адекватном лечении – прогноз для беременности и плода благоприятный. Безусловно, при выраженных нарушениях гемодинамики, положительный исход заболевания подвергается сомнению.
Профилактика фетоплацентарной недостаточности
Сегодня можно отметить хорошую тенденцию в отношении такого понятия, как «Планирование беременности». Всё больше пар относятся осознанно к этому, понимая важность и осознавая собственную ответственность друг перед другом и перед будущим малышом.
Только планируя свою беременность, только пройдя необходимые обследования и сдав соответствующие анализы, можно будет с уверенностью сказать: «Мы сделали всё, чтобы наш ребёнок появился на свет здоровым»! Ведь зная заранее, относятся ли родители к той или иной группе риска, можно предсказать ход развития беременности, вовремя её скорректировать, вылечить скрытые инфекции, словом, сделать всё, чтобы диагнозов подобно ФПН попросту не возникало. Всегда профилактика лучше и безопаснее лечения!
Конечно, незапланированная беременность до сих пор всё же является очень и очень частым событием, и в этом случае, чем раньше будущая мама отправится к врачу, тем лучше будет ей и ещё не рождённому крохе. Надо проходить все обследования в назначенный срок, сдавать анализы, показываться врачу-гинекологу так часто, как он сочтёт нужным. В идеале, ещё на этапе планирования беременности, или хотя бы с того дня, как тест показал вторую полоску, надо отказаться от алкоголя, сигарет и прочих вредных привычек. Они и так отравляют человеческий организм, и могут нанести такой необратимый вред малышу, что об этом даже страшно задуматься. Хороший здоровый сон будущей мамы должен составлять не менее 8-ми часов в сутки, ежедневных пеших прогулок на свежем воздухе должно быть как можно больше. Никаких нервов, стрессов, ругани — всё это в ваших руках, главное, поставить себе цель и чётко следовать ей.
На этапе планирования беременности профилактика фетоплацентарной недостаточности заключается в исключении неблагоприятных факторов риска:
- Ведение здорового образа жизни: полный отказ от вредных привычек;
- Полноценный сон;
- Рациональное и правильное питание;
- Прием витаминов;
- Исключение тяжелого физического труда, стрессов;
- Лечение хронических заболеваний и инфекций передаваемых половым путем
С наступлением беременности следует правильно организовывать режим для пациентки с полноценным отдыхом, включающим сон не менее 8-10 ч, в том числе и дневной в течение 2 ч, а также пребывание на свежем воздухе 3-4 ч.
Важное значение для здоровья матери и правильного развития плода имеет рациональное сбалансированное питание, с адекватным содержанием белков, жиров, углеводов, витаминов и микроэлементов. Потребление жидкости (при отсутствии отеков) для профилактики гиповолемии должно составлять 1-1,5 л.
Важно следить за увеличением массы тела во время беременности. К ее окончанию прибавка массы тела должна составлять в среднем 10- 12 кг.
Профилактические мероприятия с применением медикаментозных препаратов у беременных группы риска целесообразно проводить в 14-16 нед и в 28-34 нед.
Длительность каждого из таких курсов должна составлять 4-6 нед.
Проведение профилактической медикаментозной терапии с началом II триместра обусловлено тем, что в эти сроки беременности происходит наиболее интенсивный рост плода и плаценты, требующий адекватного кровоснабжения и оптимального энергетического обеспечения.
У беременных группы риска уже с этого срока начинает формироваться хроническая плацентарная недостаточность и особенно остро проявляются признаки дезадаптации к развивающейся беременности.
Медикаментозная профилактика усиливает компенсаторно-приспособительные реакции матери и плода, предупреждает дисциркуляторные нарушения МПК и ФПК и морфологические нарушения в плаценте.
Список литературы:
- Акушерство: учебник для медицинских вузов/ Э.К. Айламазян.
- Акушерство: Учебное пособие для студентов учреждений обеспеивающих получение высшего медицинского образования/ Г.И. Герасимович
- Фетоплацентарная недостаточность. – Учебно-методическое пособие. / С.Н.Занько.
Димитриева Татьяна Михайловна
врач-акушер-гинеколог 2-ой квалификационной
категории женской консультации
поликлиники №4
Плацентарная недостаточность: диагностика, возможные осложнения и лечение
Плацента – уникальный орган, формирующийся у женщины во время беременности. Плацента устанавливает связь между плодом и матерью. Через нее осуществляется передача будущему ребенку питательных веществ, а также дыхательная, выделительная, защитная и гормональная функции плода.
Если плацента перестает выполнять данные функции в полной мере, начинает развиваться фетоплацентарная недостаточность. По сути, недостаточность – это нарушение кровообращения в системе мать-плацента-плод.
Если подобные нарушения незначительны, то они не окажут негативного влияния на плод, но при особенно выраженной ФПН может развиться гипоксия плода (кислородная недостаточность), что впоследствии может привести к его гибели.
По своему течению существуют 2 формы ФПН: хроническая и острая
При острой ФПН может быть обнаружена преждевременная отслойка нормально расположенной плаценты, вызванная резким нарушением маточно-плацентарного кровотока, что в ряде случаев может привести к гибели плода.
При хронической ФПН (наиболее распространенной) происходит постепенное нарушение кровообращения в плаценте.
Медики выделяют компенсированную и декомпенсированную формы хронической плацентарной недостаточности.
Несмотря на не слишком выраженное ухудшение кровоснабжения при компенсированной ФПН, плод не страдает и приспосабливается к этим изменениям, благодаря компенсаторным возможностям материнского организма.
При декомпенсированной ФПН изменения имеют более стойкий характер, что приводит к недостаточному снабжению кислородом плода, к нарушению его сердечной деятельности и задержке развития.
К факторам, способным вызвать появление ФПН во время беременности, относятся:
Симптомы заболевания
При компенсированной хронической ФПН симптомы заболевания практически отсутствуют, и беременная чувствует себя вполне нормально. О наличии у нее плацентарной недостаточности женщина может узнать, как правило, во время прохождения ультразвукового исследования.
При хронической и острой декомпенсированной ФПН симптомы более выражены. Сначала отмечаются активные движения плода, после активность резко уменьшается.
Помните о том, что, начиная с 28 недели, будущая мама в норме должна ощущать движения плода не менее десяти раз в сутки. Если плод не столь активен – это является поводом для того, чтобы немедленно наведаться к своему акушеру-гинекологу.
Кроме того, если имеется задержка развития плода, при декомпенсированной ФПН отмечается некоторое уменьшение размеров живота. Правда, самостоятельно выявить данные изменения очень сложно, поэтому обычно уменьшение выявляется гинекологом во время планового приема.
И напоследок: наиболее опасный признак развития острой ФПН – это кровянистые выделения из влагалища. Это свидетельствует о том, что произошла преждевременная отслойка нормально расположенной плаценты, и подобная ситуация требует незамедлительного обращения к акушеру-гинекологу.
Диагностика ФПН
Для диагностики ФПН в акушерской практике применяют 3 основных метода: ультразвуковое исследование (УЗИ), кардиотокографию (КТГ) и допплерометрию. При любом незначительном подозрении на плацентарную недостаточность следует провести все эти обследования в обязательном порядке!
При УЗИ будет оцениваться двигательная активность плода, состояние плаценты (ее зрелость и толщина), количество околоплодных вод и размеры плода.
Современные аспекты диагностики и лечения синдрома задержки роста плода uMEDp
Синдром задержки роста плода (СЗРП) является актуальной проблемой перинатологии. Эта патология оказывает влияние не только на внутриутробное состояние плода, но и на последующее развитие ребенка и становление всех функций его организма. Многочисленными исследованиями доказано, что имеется взаимосвязь между массо-ростовыми параметрами новорожденного и его дальнейшим физическим, психомоторным и неврологическим развитием не только в момент появления на свет, но и спустя много лет (1, 3, 4, 8, 11, 12).
По сведениям отечественных авторов СЗРП в акушерской практике встречается у 5-17,6% пациентов, причем частота СЗРП у недоношенных детей выше и составляет 15,7-22%, так как причины и патогенетические механизмы патологических состояний, приводящих к преждевременным родам и СЗРП часто совпадают (13, 15, 18, 21).
Чаще патогенетическим аспектом в развитии СЗРП является плацентарная недостаточность – морфофункциональные изменения в фетоплацентарной системе, приводящие к нарушению плодово-плацентарной гемодинамики, транспорта кислорода и питательных веществ к плоду, изменению метаболизма и эндокринной регуляции. Учитывая тесную взаимосвязь биологических процессов, происходящих в плаценте и в организме плода, основой развития СЗРП в большинстве случаев является хроническая фетоплацентарная недостаточность (7, 9, 10, 14, 15, 19). Скрининговое исследование, проводимое в 30-34 недели беременности, позволяет обнаружить максимальное количество случаев СЗРП, обусловленных плацентарной недостаточностью. Эффективность скринингового обследования повышается при оценке нескольких обязательных компонентов: фетометрии, плацентографии и оценки околоплодных вод. Определение маточно-плодово-плацентарного кровотока с помощью допплерометрии и признаков страдания плода при КТГ дает возможность объективно оценить состояние плода, степень тяжести его внутриутробного страдания, а также компенсаторные возможности в условиях хронической гипоксии (1, 2. 5, 6, 20).
Наличие анатомических особенностей строения и даже аномалий развития плаценты не должны отождествляться с понятием плацентарной недостаточности, но должны явиться поводом к проведению углубленного комплексного обследования плода. Диагноз СЗРП, поставленный только на основании результатов эхографического исследования, не является полным. Отставание фетометрических данных от гестационного срока при отсутствии пороков развития может быть обусловлено конституциональными особенностями плода и не требовать специального лечения и изменения акушерской тактики. Обязательным этапом в комплексном обследовании плода после установления эхографического диагноза СЗРП является функциональное исследование и оценка компенсаторных возможностей системы «мать-плацента-плод». Для комплексной оценки состояния фетоплацентарной системы при подозрении на СЗРП во всех случаях необходимо использовать допплерографию. Допплерографическое исследование в акушерстве целесообразно проводить не ранее 16-18 недель беременности. При сроке от 18-19 до 25-26 недель допплерометрия – метод выбора, т.к. биофизический профиль плода информативен с 26 недель, а кардиотокография еще не показательна.
Изменение нормальных показателей допплерометрии есть неспецифическое проявление многих патологических состояний плода, причем во многих случаях предшествующих появлению клинических симптомов, важно, что это относится и к основным патологическим состояниям при беременности – СЗРП, гипоксии плода, гестозу и др. (14, 16, 17, 19, 21).
Не все формы плацентарной недостаточности сопровождаются существенными изменениями маточно-плацентарного и плацентарно-плодового кровотока. С этим, по-видимому, связано большинство ложноотрицательных результатов. Гипердиагностика СЗРП ведет и к увеличению числа пренатальных исследований, и к необоснованной лекарственной интервенции в фетоплацентарный комплекс, а также к активизации акушерской тактики и негативному воздействию на психику пациентки.
Поэтому следует подчеркнуть необходимость комплексного учета данных трех основных взаимодополняющих методов исследования: эхографии, кардиотокографии и допплерометрии.
Диагностическая значимость допплерометрии в маточной артерии и в артериях пуповины плода достоверна только при нарушении кровотока, при патологических кривых скоростей кровотока. Однако при нарушении кровотока различной степени и несоответствии размеров плода сроку беременности (при подозрении на симметричную форму гипотрофии) этот метод может использоваться для дифференциальной диагностики со здоровым маловесным плодом. Наличие нормального кровотока при небольшом по размерам плоде в большинстве случаев будет говорить о наличии здорового маловесного плода.
Цель исследования
Изучить влияние терапии Актовегином при СЗРП на состояние фетоплацентарного комплекса у беременных по данным фетометрии и допплерометрии.
Материалы и методы
Нами было проведено комплексное динамическое обследование 22 (100%) беременных женщин в сроке беременности 30-32 недели с СЗРП на базе Клинического родильного дома № 26 г. Москвы. Возраст беременных колебался от 18 до 35 лет и составил в среднем 25,6 +/- 4,2 года.
Исследования фетоплацентарной системы проводили при помощи эхографии и допплерометрии в 30-32 недели. Для коррекции метаболических изменений проводилась терапия препаратом Актовегин по 1 табл. 3 раза в день в течение 2 недель, после чего проводили контрольное исследование.
Исследования выполнены с помощью ультразвукового диагностического прибора «ALOKA SSD-5500 ProSound» (Япония). Комплексное ультразвуковое исследование включало фетометрию, плацентографию, оценку количества и качества околоплодных вод. Оценивали соответствие результатов фетометрии нормативным для данного срока беременности. Структуру плаценты расценивали как соответствующую ее нормальному состоянию в случае, если степень ее зрелости (согласно классификации Crannum P. и соавт., 1979) и толщина соответствовали сроку беременности, отсутствовали патологические включения в ее структуре, а расположение плаценты было нормальным. Определение изучаемых показателей проводили по известным методикам.
Для оценки маточно-плодово-плацентарного кровотока в артерии пуповины и маточных артериях проводилось допплерометрическое исследование. В спектре артериальных сосудов определяли общепринятый уголнезависимый показатель сосудистой резистентности: систоло-диастолическое отношение (СДО).
По возрасту и паритету беременные женщины были сопоставимы.
Результаты исследования
При интерпретации данных ультразвукового исследования мы исходили из того, что полученная информация является отражением состояния фетоплацентарной системы и ее компенсаторно-приспособительных реакций на момент исследования. Фетометрические данные, структура плаценты и объем околоплодных вод определяются как маркеры стабильности фетоплацентарной системы, т.е. отражают степень стабильности, соответствия сроку беременности в процессе формирования и развития.
Из всех обследуемых беременных женщин 22 (100%), у 18 (81,8%) пациенток имело место СЗРП асимметричной формы, а у 4 (18,2%) – симметричной формы. Причем у 19 (86,4%) отставание параметров фетометрии от нормативных для данного срока беременности составляет 2 недели, что соответствует I степени СЗРП, а у 3 (13,6%) – более 2 недель, что соответствует II степени СЗРП. Чаще выявляется СЗРП I степени – 16 (88,9%) случаев при ассиметричной форме СЗРП и 3 (75%) – при симметричной.
Из всех обследуемых беременных при комплексном обследовании эхо-признаки преждевременного созревания плаценты выявлены в 12 (54,5%) случаях. Многоводие и маловодие при этом наблюдалось практически в одинаковом количестве случаев – 3 (13,6%) и 4 (18,2%) соответственно.
При исследовании маточно-плодово-плацентарного кровотока мы получили следующие данные: в 6 (27%) случаях кровоток был не нарушен, нарушение маточно-плацентарного кровотока (IА степени) было выявлено в 5 (23%) случаях, нарушение плодово-плацентарного кровотока (IБ степени) отмечалось в 8 (36%) случаях и нарушение маточно-плодово-плацентарного кровотока II степени – в 3 (14%) случаях.
Причем при симметричной форме СЗРП патологические показатели кровотока были выявлены во всех случаях: IА степени – 1(25%), IБ степени – 2 (50%), II степени – 1 (25%). Тогда как при асимметричной форме в трети случаев – 6 (33,3%) – значения кровотока регистрировались в пределах нормы, нарушение маточно-плацентарного кровотока (IА степени) – 4 (22,2%), нарушение плодово-плацентарного кровотока (IIБ степени) – 6 (33,3%) и нарушение кровотока II степени – 2 (11,1%).
У 12 беременных определялись эхо-признаки преждевременного созревания плаценты, причем при симметричной степени СЗРП – во всех случаях: 4 (100%), а при асимметричной – 8 (44,4%). Нормальные показатели кровотока в случаях с преждевременным созреванием плаценты регистрировались у 2 (16,7%) беременных. Нарушение кровотока при преждевременном созревании плаценты наблюдалось чаще и составило 10 (83,3%) случаев, причем преимущественно отмечалось повышение резистентности маточных артерий – 6 (50%), тогда как повышение резистентности в артерии пуповины отмечалось в 2 (16,7%) случаев изолированно и в 2 (16,7%) – совместно с повышением резистентности в маточной артерии, что характеризует нарушение маточно-плодово-плацентарного кровотока II степени.
При СЗРП в результате снижения компенсаторных возможностей фетоплацентарной системы достоверно чаще встречается нарушение маточно-плодово-плацентарного кровотока, тогда как нормальный кровоток регистрировался в трети случаев. Если учитывать сочетание преждевременного созревания плаценты и СЗРП, то случаев нарушения кровотока в 5 раза больше по сравнению с нормальными показателями – 10 (83,3%) и 2 (16,7%) соответственно/
Всем беременным назначалась терапия препаратом Актовегин по 1 табл. 3 раза в день в течение 2 недель, после чего было проведено контрольное обследование с целью оценки эффективности терапии и для решения вопроса о дальнейшей тактике ведения беременных в соответствии с полученными результатами.
Терапия Актовегином была назначена в связи с тем, что этот препарат активизирует обмен веществ в плаценте, улучшает микроциркуляторные процессы в плацентарной ткани, нормализует кровообращение в плацентарных сосудах, улучшает реологические и коагуляционные свойства крови в системе «мать-плацента-плод», вследствие чего улучшаются метаболические процессы и регулируется энергообеспечение тканей.
Активное вещество Актовегина представляет собой депротеинизированный гемодериват из телячьей крови с низкомолекулярными пептидами и дериватами нуклеиновых кислот. Актовегин стимулирует клеточный метаболизм путем увеличения транспорта и накопления глюкозы и кислорода и усиления его внутриклеточной утилизации. Эти процессы приводят к ускорению метаболизма АТФ и повышению энергетических ресурсов клетки. Вторичным эффектом является улучшение микроциркуляции и кровоснабжения ишемизированных тканей. Поглощение клеткой большего количества кислорода приводит к активации процессов аэробного окисления, что увеличивает энергетический потенциал тканей. Доказано, что эффекты Актовегина наиболее выражены при гипоксическом характере повреждения тканей.
Стимулируя аэробное окисление, Актовегин улучшает перфузию глюкозы в плаценте, повышает доставку кислорода, нормализует показатели гемодинамики и обладает выраженным влиянием на белковый обмен плода.
Полученные результаты при контрольном исследовании через 2 недели приема препарата свидетельствовали о терапевтическом эффекте Актовегина при лечении СЗРП. После курса лечения соответствие результатов фетометрии нормативным для данного срока беременности отмечалось у 18 (82%) беременных, причем полностью адекватный рост плода определялся в 10 (48%) случаях, а незначительное отставание параметров фетометрии в пределах одной недели – у 8 (36%) беременных. Отставание фетометрических параметров в клинически значимых значениях (более 2 недель) было отмечено в 4 (18%) случаях. Во всех случаях СЗРП при контрольном обследовании отмечена положительная динамика, но требовалось продолжение лечения более длительным курсом.
Анализ результатов допплерометрического исследования выявил значительное улучшение кровотока после курса проведенного лечения. В 15 (68%) случаях кровоток не был нарушен; нарушение маточно-плацентарного кровотока (IА степени) было выявлено в 6 (27%) случаях, нарушение плодово-плацентарного кровотока (IБ степени) отмечалось в 1 (5%) случае. Нарушение маточно-плодово-плацентарного кровотока II степени после лечения выявлено не было.
Таким образом, применение препарата Актовегин способствует уменьшению патологических изменений в плаценте и адекватному росту и развитию плода, а также улучшает общее состояние беременных.
Гемодинамические изменения в системе «мать-плацента-плод» при СЗРП универсальны, однотипны и не зависят от природы ведущего этиологического фактора. Адекватная оксигенация плода возможна только при неизмененном состоянии маточно-плодово-плацентарного кровотока. Применение Актовегина при осложненном течении беременности позволяет улучшить состояние матери и внутриматочное развитие плода, создается возможность для пролонгирования беременности и улучшения показателей перинатальной смертности и заболеваемости новорожденных.
Целесообразно при сроке беременности 30-32 недели проводить скрининговое обследование беременных женщин с целью выявления адекватного роста плода по соответствию нормативным данным фетометрии гестационному сроку и функционального состояния плода. Фундаментальный принцип антенатальной оценки функционального состояния плода: точность диагностики с помощью различных методов тем выше, чем больше параметров биофизической активности плода принимается во внимание при его обследовании.
Комплексное обследование беременной при диагностики СЗРП:
- определить форму и степень тяжести СЗРП по данным фетометрии;
- оценить степень функциональных и структурных изменений в фетоплацентарной системе и ее адаптационно-приспособительные возможности, с помощью кардиотокографии и/или допплерометрии с учетом срока беременности;
- установить вероятные этиологические факторы и патогенетические механизмы развития СЗРП.
На основании полученных данных можно достоверно оценить прогноз и соответственно определить дальнейшую тактику ведения беременности и родов.
Плацентарная недостаточность – StatPearls – NCBI Bookshelf
Непрерывное обучение
Плацентарная недостаточность – это состояние, при котором происходит нарушение ремоделирования сосудов плаценты, что приводит к нарушению плацентарной системы, что приводит к ацидозу и гипоксемии плода. Наиболее частыми последствием этого состояния для плода являются задержка внутриутробного развития, недоношенность или, к сожалению, гибель плода. Чтобы снизить риск заболеваемости и смертности плода, особенно при беременностях с высоким риском, следует проводить регулярный пренатальный скрининг с помощью ультразвуковой допплерографии, чтобы повысить шансы обнаружения и диагностики.В этом упражнении рассматривается патофизиология, оценка и возможные методы лечения плацентарной недостаточности, а также подчеркивается роль межпрофессиональной группы в ведении пациентов с этим заболеванием.
Цели:
Рассмотреть факторы риска, связанные с плацентарной недостаточностью.
Опишите типичные результаты визуализации при ультразвуковой допплерографии, связанные с плацентарной недостаточностью.
Определите наиболее частые нежелательные явления, связанные с плацентарной недостаточностью.
Введение
Плацентарная недостаточность связана с различными акушерскими расстройствами, такими как преэклампсия и задержка внутриутробного развития, которые предрасполагают к преждевременным родам, ведущей причине перинатальной заболеваемости и смертности во всем мире. Плохая функция плаценты чаще всего описывается термином «плацентарная недостаточность» в медицинском сообществе; однако одно исследование выявило проблему, заключающуюся в том, что не существует стандартизированного определения или консенсуса в отношении патогномоничных признаков, относящихся к плацентарной недостаточности.[1]
Это создает много проблем, когда дело доходит до изучения плацентарной недостаточности в литературе, но общее понимание таково, что плацентарная недостаточность – это процесс, при котором происходит прогрессирующее ухудшение функционирования плаценты, так что кислород и питательные вещества переносятся к плоду через плацента уменьшается, что приводит к декомпенсированной гипоксии и ацидозу. [2] [3] Этот процесс приводит к гипоксемии плода, которая затем стимулирует подавление метаболических требований плода для сохранения уже доступных питательных веществ, что приводит к задержке внутриутробного роста плода.С гистопатологической точки зрения плацентарная недостаточность может быть определена при фиброзе ворсинок хориона, маточно-плацентарном тромбозе, инфаркте плаценты, отложениях фибрина или уменьшении количества и площади поверхности ворсинок капилляров [4].
Следует отметить, что инфаркты плаценты могут быть нормальным явлением, поскольку они наблюдаются примерно в 25% случаев нормальных доношенных беременностей; однако было показано, что учащение инфаркта плаценты связано с плацентарной недостаточностью и, следовательно, с задержкой внутриутробного развития (ЗВУР).И МРТ, и ультразвуковые исследования, направленные на выявление плацентарной недостаточности, продемонстрировали уменьшение площади и объема плаценты, а также увеличение ее толщины в дополнение к плаценте шаровидной формы на МРТ [5].
Этиология
На сегодняшний день основные этиологии, которые могут привести к плацентарной недостаточности, плохо изучены и все еще изучаются. Известны связанные факторы риска для матери, которые включают преэклампсию или другие гипертонические расстройства у матери, употребление сигарет матерью, употребление наркотиков матерью, включая кокаин или героин, потребление алкоголя матерью, первородство, пожилой возраст матери и предшествующие роды новорожденных с ЗВРП.[2] [6]
Исследования, анализирующие формы волны Доплера в различных сосудах плаценты матерей, которые курили сигареты во время беременности, продемонстрировали снижение формы волны скорости кровотока, что указывает на то, что воздействие никотина может привести к изменению сосудистой сети плаценты. [6]
Любое заболевание матери, которое может привести к нарушению кровообращения плода, подвергает плод риску плацентарной недостаточности. Кроме того, некоторые лекарства, такие как противоопухолевые, противосудорожные или антикоагулянты, могут мешать росту плода.Экстремальные значения индекса массы тела матери, включая недоедание матери, также были связаны с развитием ЗВУР новорожденных [7]. Исследования осложненных беременностей с ЗВУР показали, что имела место неполная трансформация сосудистой сети плаценты на ранних сроках беременности, что можно выявить с помощью ультразвуковых допплеровских исследований. [5] [8]
Эпидемиология
Недоношенность – основная причина перинатальной смерти, за которой следует задержка внутриутробного развития плода, что осложняет примерно от 4% до 6% известных беременностей.Плацентарная недостаточность – потенциальная причина преждевременных родов, преэклампсии, ЗВУР и мертворождений, которые могут возникать в 10-15% беременностей. Для плода с ЗВУР риск самопроизвольных преждевременных родов в три раза выше по сравнению с плодом без задержки роста, а также в пять-шесть раз выше риск развития перинатальной смерти [2]. К сожалению, около 50% новорожденных с ЗВУР выявляются только после родов.
Патофизиология
Хотя основная этиология плацентарной недостаточности неизвестна, существуют предложенные механизмы.Плацентарная недостаточность связана со снижением кровотока через пупок к плоду, что может быть вторичным по отношению к увеличению сопротивления сосудов пуповины и плаценты. Это повышенное сопротивление может быть визуализировано как аномальные формы волны допплеровского кровотока в пупочной артерии и может быть вторичным по отношению к аномалии внедрения ворсинок в плацентарную мембрану, нарушению перфузии между пупком и плацентой или снижению маточно-плацентарного кровотока. Исследования допплерографии пупочной артерии показали, что степень повреждения плаценты напрямую связана со степенью повреждения плода во время беременности.[9]
Основная роль плаценты – служить связующим звеном между кровообращением плода и матери. Для этого необходимо установить прилегание плаценты и ремоделирование маточной артерии, чтобы обеспечить доставку питательных веществ к растущему плоду. Отличительным признаком успешной плацентации является ремоделирование маточных артерий. После оплодотворения образуется бластоциста, которая состоит из внутренней клеточной массы, которая в конечном итоге станет плодом, и внешней оболочки, называемой трофобластом, которая становится эмбриональной частью плаценты.Чтобы способствовать прикреплению плаценты, цитотрофобласт, который является внутренним слоем трофобласта, секретирует матриксные металлопротеиназы, которые разрушают блестящую оболочку, и прилипание облегчается за счет образования закрепляющих ворсинок и экспрессии молекул адгезии. [10] Это вторжение в маточно-плацентарные артерии позволяет преобразоваться в расширенные неэластичные сосуды с низким сопротивлением, которые лишены материнского вазомоторного контроля, что приводит к усилению маточно-плацентарной перфузии, что позволяет удовлетворить потребности плода.[5] Любое нарушение процесса ремоделирования может привести к увеличению сопротивления маточно-плацентарных сосудов, что приведет к гипоперфузии плаценты и ее последующим эффектам, включая активацию коагуляции, дисфункцию эндотелиальных клеток, тромбоз плаценты и отложения фибрина, что связано с разработка ЗВУР. [5] [3] Кроме того, если происходит потеря фокальной адгезии эндоваскулярных трофобластов, может наблюдаться уменьшение площади плацентарной поверхности, связанное с плацентарной недостаточностью.Это уменьшение площади поверхности плаценты, наряду с увеличением ее толщины, создает шаровидный вид плаценты, который, как предполагается, действует как компенсаторный механизм плацентарной недостаточности.
Внутриутробная среда – это среда с низким содержанием кислорода, и поэтому кровообращение плода должно быть гибким, чтобы адаптироваться к любым изменениям, которые происходят с маточно-плацентарной функцией. [9] Эта гипоксическая среда стимулирует ангиогенез, в результате чего между кровообращением матери и межворсинчатым пространством устанавливаются сосудистые связи.Теперь, когда создана сосудистая и питательная сеть поддержки, формируется трофобласт ворсинок, который состоит из микроворсинок матери и базального слоя плода [10]. Для поддержания функции плаценты требуется большое количество энергии, на что указывает тот факт, что в обычном физиологическом состоянии плацента потребляет примерно 70% глюкозы и 40% кислорода, который обычно поступает в матку. Следовательно, чтобы достичь оптимального роста и развития плода, доставка питательных веществ в матку должна превышать потребность плаценты, чтобы оставшиеся питательные вещества оставались для использования плодами.[10] Следовательно, любое нарушение доставки питательных веществ в матку влияет на доставку питательных веществ к плоду.
На успешную плаценту может отрицательно повлиять латерализация, когда инвазия плаценты благоприятствует одной стороне, а плацента не имплантируется центрально. Если плацента остается асимметричной до срока, ультразвуковая допплерография покажет стойкую выемку на неимплантированной стороне, что приведет к относительной плацентарной недостаточности. Латерализация плаценты также была связана с повышенным риском развития материнской преэклампсии и, следовательно, последующей плацентарной недостаточности.[9] [11]
История и физика
Поскольку ограничение внутриутробного развития является одним из основных исходов, связанных с плацентарной недостаточностью, большинство выживших новорожденных рождаются преждевременно и известны как новорожденные с «чрезвычайно низкой массой тела при рождении» (ELBW) или в зависимости от того, когда произошло нарушение кровоснабжения, они могут иметь измененные пропорции тела при рождении. [10] Если плацентация не удается, последующие эффекты, такие как ЗВУР, клинически очевидны при допплеровских исследованиях примерно на 26 неделе беременности.[9]
Когда есть опасения по поводу ЗВУР, будь то вторичный по отношению к плацентарной недостаточности или другой этиологии, плод выиграет от частого комбинированного мониторинга с использованием как допплеровского, так и биофизического профилей. Эта комбинация методов скрининга позволяет распознать снижение эффективности, наблюдаемое, когда IUGR связано с проблемами плаценты. Используя допплеровские исследования, неудачную плацентацию можно визуализировать по наличию надреза в маточных артериях, а также по увеличению сопротивления в пупочной артерии с прогрессированием либо до отсутствующего, либо до обратного конечного диастолического объема.Одним из первых признаков, которые можно увидеть на биофизическом профиле, когда есть опасения по поводу компрометации плода, является нереактивное отслеживание сердечного ритма плода. Следующее будет либо плохой, либо потерей движений тела плода, дыхательных движений и тонуса. Эти особенности снижения допплеровского статуса и плохих биофизических профилей типичны при дистрессе плода, что является обычным явлением при плацентарной недостаточности и может указывать на необходимость родов.
Оценка
В настоящее время отсутствуют критерии диагностики плацентарной недостаточности, так как отсутствуют стандартизированные методы диагностики.Частично проблема связана с широким разнообразием терминологии, используемой для описания так называемой «плацентарной недостаточности». [1] Однако по мере совершенствования технологий ультразвуковая допплерография оказалась полезным инструментом для оценки состояния плода. и плацентарное кровообращение как в здоровом, так и в болезненном состоянии. Было обнаружено, что четыре метода допплера являются основополагающими для получения полезной информации о кровообращении у плода и матери, включая исследования пупочной артерии, исследования маточной артерии, исследования средней мозговой артерии и исследования венозного протока.[9] По мере того, как плод продолжает созревать во время беременности, происходит множество изменений кровообращения, которые можно оценить с помощью ультразвуковой допплерографии.
До наступления беременности маточные артерии демонстрируют низкий диастолический кровоток, высокое сопротивление и эластичную отдачу, отмеченную в виде ранних диастолических насечек. Успешная плацентация включает удаление интимы мышцы из сосудистой сети, так что кровеносные сосуды будут иметь сильный диастолический поток, минимальное сопротивление и не обладают эластичными свойствами.Когда плацентация проходит успешно, ультразвуковая допплерография демонстрирует, что ремоделирование происходит быстро, так что к 12 неделе беременности происходит потеря надреза, а сопротивление становится низким к 20 неделе беременности или раньше. Когда происходит неэффективность плацентации, надрез сохраняется, а сопротивление остается высоким, что, как было показано, коррелирует с материнскими гипертензивными осложнениями плода, включая ЗВУР, преэклампсию и гибель плода [9]. Было показано, что использование маточной артерии для допплеровского скрининга для оценки зазубрин и сопротивления, чтобы помочь идентифицировать эти ситуации высокого риска, примерно на 85% чувствительно для выявления тяжелой ЗВУР и преэклампсии.
По мере увеличения сопротивления в плаценте допплеровские исследования пупочной артерии могут продемонстрировать нормальную, пониженную, отсутствующую или обратную конечную диастолическую скорость [12] [8]. Высокое сопротивление плаценты на ранних сроках беременности является нормальным явлением, поэтому можно ожидать, что конечная диастолическая скорость будет отсутствовать при допплеровских исследованиях до 12–14 недель беременности. При успешном прорастании плаценты снижение сопротивления и допплеровские исследования пупочной артерии должны продемонстрировать непрерывный кровоток к 14–18 неделе беременности.[9] Устойчивое сопротивление пупочной артерии на протяжении беременности является показателем повышенного риска плацентарной недостаточности.
В то время как допплеровские исследования пупочной артерии предоставляют важную информацию, относящуюся к возможному поражению плаценты, ценным дополнением является также допплерография средней мозговой артерии (СМА). MCA предоставляет информацию о системных ответных реакциях кровообращения у развивающегося плода, поскольку представляет собой сопротивление в церебральной микроциркуляции.Нормальный допплерографический анализ MCA демонстрирует высокое сопротивление на протяжении всей беременности; тем не менее, заболевание плаценты может быть идентифицировано при увеличении диастолического кровотока и снижении индекса пульсации. Следовательно, допплеровские исследования MCA могут предоставить важную дополнительную информацию, когда есть опасения по поводу тяжелой ЗВУР, указывая на то, что может быть компромисс плода и может потребоваться вмешательство.
Другой формой допплерографии, которая дает представление о здоровье плаценты и плода, является венозный допплер, который передает информацию, относящуюся к сердечным данным, когда кровообращение плода испытывает стресс.Венозная волна, которая, как было доказано, обеспечивает наилучшие клинические данные, – это венозный проток. Венозный проток имеет множество преимуществ по сравнению с другими формами венозных волн, в том числе его чувствительность к изменениям оксигенации, он является одним из основных регуляторов венозного возврата при аномальном и нормальном кровообращении плода, он не зависит от сердечной функции, он служит прямой канал для просмотра ретроградных пульсовых волн правого предсердия, и, наконец, поскольку он имеет повышенный и фокусный цветовой допплеровский сигнал с 12 недель беременности до 40 недель беременности, его очень легко визуализировать.[9] Если аномальный венозный проток или ретроградная предсердная волна визуализируются с помощью допплерографии примерно на 12–14 неделе беременности, существует повышенный риск сердечных аномалий плода, и это также служит возможным предшественником, указывающим на тяжелую ЗВРП на основе плаценты.
МРТ дает дополнительную информацию для обнаружения и диагностики плацентарной недостаточности. Пустоты потока возникают, когда наблюдается потеря сигнала МРТ в кровеносном сосуде, по которому интенсивно течет кровь.При использовании Т2-взвешенного быстрого сбора данных с усилением релаксации (RARE) плацентарная недостаточность может быть обнаружена, когда наблюдается уменьшение пустот между плацентой и маткой, поскольку это можно рассматривать как отражение снижения маточно-плацентарной перфузии. [5] Дополнительным преимуществом МРТ является то, что она обеспечивает высокий контраст мягких тканей. Следовательно, сосудистые патологии плаценты, включая кровоизлияния и инфаркты, могут быть обнаружены с помощью МРТ плаценты, что указывает на высокий риск плацентарной недостаточности и последующего IUGR.
Лечение / ведение
В настоящее время не существует известного лечения плацентарной недостаточности, кроме доставки плода, если это возможно. Было показано, что низкие дозы аспирина и использование антиоксидантной терапии, включая витамины C и E, способствуют улучшению плацентации в тех случаях, когда нет уверенности в ее успешности. [9] Исследования продемонстрировали снижение перинатальной смертности примерно на 38% при использовании раннего ультразвукового допплера при подозрении на ЗВУР во время беременности.[12] [13]
Женщины из группы высокого риска, например с хронической гипертензией, коагулопатиями или преэклампсией в анамнезе, могут получить пользу от ультразвукового допплеровского скрининга на сроке от 12 до 14 недель гестации, потому что, если очевидны двусторонние насечки затем следует начать терапию низкими дозами аспирина.
Исследования in vitro показали, что гепарин может стимулировать неоангиогенез, а также улучшать перфузию плаценты. Антикоагулянтные свойства гепарина проявляются в его способности мобилизовать фактор ингибирования ткани в кровоток и в том факте, что он также усиливает активность антитромбина.Дополнительные преимущества гепарина при рассмотрении плацентарной недостаточности и ее последующих последствий заключаются в том, что гепарин способствует пролиферации трофобластов, уменьшает воспаление за счет подавления каскада комплемента, снижает апоптоз, а также косвенно действует как фактор роста [3].
Было также показано, что гепарин активирует определенные белки, участвующие в ангиогенезе и развитии плаценты. К ним относятся ангиопоэтин-2, который отвечает за ремоделирование сосудов ворсинок хориона, лептин, который отвечает за регуляцию переноса питательных веществ, а также рецептор-3 фактора роста эндотелия сосудов, тканевый ингибитор матричной металлопротеазы-1, фактор некроза опухоли-альфа. и ангиостатин.Основываясь на его свойствах и предварительных данных, некоторые исследования показали, что гепарин может использоваться в качестве профилактического средства лечения плацентарной болезни.
Дифференциальная диагностика
Существует множество факторов, которые могут способствовать развитию плацентарной недостаточности, и известно, что ЗВУР является основным последующим осложнением; однако иногда бывает трудно дифференцировать новорожденного с малым для гестационного возраста (SGA) новорожденного от новорожденного с IUGR. Одним из основных преимуществ допплерографических исследований, особенно пупочной артерии, является то, что допплерография аномальной пупочной артерии может использоваться для дифференциации патологического ЗВУР и новорожденного с малым для гестационного возраста новорожденным, таким образом определяя, какая беременность потребует тщательного наблюдения. по сравнению с обычным мониторингом.[9] [14]
Когда средний расчетный вес плода ниже 10-го процентиля для определенного срока гестации, этот плод является SGA. И наоборот, плод с ЗВУР не сможет достичь нормального роста, как правило, вследствие плацентарной недостаточности, генетического заболевания или инфекции. [14] Следовательно, новорожденный с SGA будет физически маленьким, но в целом здоровым, по сравнению с новорожденным с IUGR, который также может быть физически маленьким, но, вероятно, его здоровье будет поставлено под угрозу.
При рассмотрении дифференциальных диагнозов, которые способствуют плацентарной недостаточности, существуют известные сопутствующие заболевания, включая, помимо прочего, преэклампсию, гипертензивные расстройства у матери, поскольку они оба влияют на сопротивление плаценты и маточно-плацентарный кровоток.Другие болезни, которые следует учитывать, включают олигогидрамнион и материнское недоедание или ограничение калорийности.
Прогноз
Если новорожденный пострадал от ЗВУР в результате плацентарной недостаточности и пережил перинатальный период, он подвергается более высокому риску развития когнитивных нарушений в детстве, включая церебральный паралич и судороги, по сравнению с новорожденными без ограничения роста. Пациенты, страдающие плацентарной недостаточностью, часто имеют аномальные формы волны доплеровского кровотока (DFVW) в пупочной артерии, и когда в одном исследовании сравнивали DFVW младенцев, у которых была плацентарная недостаточность внутриутробно, с младенцами, у которых не было плацентарной недостаточности, они обнаружили, что младенцы, у которых были аномальные У DFVW также был более низкий IQ в 5-летнем возрасте.Есть также свидетельства того, что страдание от ЗВУР в младенчестве предрасполагает к хроническим заболеваниям во взрослом возрасте, включая повышенный риск развития ишемической болезни сердца, гипертонии и диабета. [2]
Чтобы улучшить прогноз для новорожденного, приоритетом должны быть вмешательства, которые позволяют максимально увеличить гестационный возраст при рождении. Подсчитано, что каждую неделю, когда беременность продлевается для плодов на сроке от 24 до 28 недель, выживаемость без связанных с этим последствий увеличивается примерно на 10–15%.[3]
Осложнения
Последующие эффекты плацентарной недостаточности на развивающийся плод сложны и многофакторны; однако основными эффектами, как правило, являются плацентарная дыхательная недостаточность и гипоксемия плода, которые способствуют задержке внутриутробного развития и связанным с этим эффектам, включая недоношенность. [10] [14]
Самым пагубным осложнением, очевидно, является полное отсутствие плацентации и, как следствие, выкидыш. Для развивающегося плода степень аномалий пупочной артерии, наблюдаемых при допплерографии, коррелирует с ацидозом, потребностями в реанимации, прессорной поддержкой, респираторной поддержкой, а также мультисистемной органной недостаточностью, которая обычно возникает при гипоксемии, поскольку это вызывает перераспределение кровотока у развивающегося плода к важным органам, таким как мозг и сердце, за счет других соответствующих органов, таких как кишечник и почки.[14] Кроме того, когда допплеровские исследования демонстрируют отсутствие или обратный конечный диастолический поток, у новорожденных увеличивается частота внутрижелудочковых кровотечений. [9]
С увеличением сопротивления плаценты во время беременности плод, который уже является ЗВУР, подвергается дополнительному риску гипогликемии, гипоксически-ишемической энцефалопатии, тромбоцитопении, лейкопении и анемии. [8] Кроме того, есть данные, указывающие на то, что младенцы подвержены риску развития когнитивного дефицита в детстве, а затем развития хронических заболеваний во взрослом возрасте.
Сдерживание и обучение пациентов
Во время беременности обязательно проводить регулярный пренатальный скрининг и ультразвуковое наблюдение, чтобы обеспечить наилучший результат для новорожденного. Хотя окончательных профилактических мер плацентарной недостаточности не существует, как только она будет обнаружена с помощью УЗИ, МРТ, ДПП или любой комбинации этих методов, могут быть начаты вмешательства, такие как терапия гепарином, в надежде продлить срок беременности с надеждой на минимизацию ацидоз и гипоксия и, как следствие, ЗВУР, недоношенность или гибель плода.Необходимо провести дальнейшие исследования вмешательств и лечения, которые во время беременности принесут наибольшую пользу развивающемуся плоду.
Жемчуг и другие проблемы
Не существует однозначного лекарства от плацентарной недостаточности, но последствия можно свести к минимуму, если поставить диагноз на ранней стадии, а мать получит адекватную дородовую помощь. Недавний метанализ показал, что гепарин может способствовать росту плода и продлевать беременность, если гепарин назначается при высоком подозрении на плацентарную недостаточность, но не способствует снижению неблагоприятных исходов у новорожденных.
Улучшение результатов бригады здравоохранения
На основании допплеровских исследований самые ранние признаки неудачной плацентации, вероятно, не будут обнаружены до, по крайней мере, после 12 недель беременности, что коррелирует с проспективным когортным исследованием, которое продемонстрировало скрининговую функцию плаценты при беременностях с высоким риском во втором триместре по сравнению с первым был лучшим предиктором неблагоприятных перинатальных исходов [15].
При обсуждении плацентарной недостаточности будет по крайней мере две команды, если не больше, которые будут участвовать в уходе за пациентами, так как одна команда будет нести ответственность за пренатальный мониторинг матери и плода, а другая команда будет заботиться для новорожденных в послеродовой период.Ведение матери и ребенка с ЗВРП требует наличия междисциплинарной команды, состоящей из акушеров / гинекологов, реаниматологов новорожденных, медсестер акушера и отделения интенсивной терапии, респираторных терапевтов, фармацевтов, пульмонологов, а иногда и других специалистов, включая хирургию, инфекционные заболевания или генетику.
У новорожденных с ЗВРП часто развивается хроническое заболевание легких, вторичное по отношению к их недоношенности, и может потребоваться прием нескольких лекарств, а также домашний кислородный контроль, или у них может развиться несколько инфекций, включая некротический энтероколит или поздний сепсис, все из которых требует координации между вышеупомянутые команды, чтобы обеспечить улучшенные результаты для пациента.Иногда, в зависимости от исхода беременности, важно привлечь комитет по этике или группу паллиативной помощи. Часто семьям легче организовать семейные собрания, в которых присутствует хотя бы один член от каждой специальной группы, поскольку это улучшает общение между всеми командами и дает семьям возможность задать свои вопросы сразу всем специалистам.
Дополнительное образование / Контрольные вопросы
Список литературы
- 1.
- Хант К., Кеннеди С.Х., Ватиш М. Определения и сообщения о плацентарной недостаточности в биомедицинских журналах: обзор литературы. Eur J Obstet Gynecol Reprod Biol. 2016 Октябрь; 205: 146-9. [PubMed: 275
- ]
- 2.
- Ганьон Р. Плацентарная недостаточность и ее последствия. Eur J Obstet Gynecol Reprod Biol. 22 сентября 2003 г .; 110 Приложение 1: S99-107. [PubMed: 12965097]
- 3.
- Mazarico E, Molinet-Coll C, Martinez-Portilla RJ, Figueras F. Терапия гепарином при плацентарной недостаточности: систематический обзор и метаанализ.Acta Obstet Gynecol Scand. 2020 Февраль; 99 (2): 167-174. [PubMed: 31519033]
- 4.
- Агарвал Р., Тивари А., Вадхва Н., Радхакришнан Г. Результаты гистопатологического исследования плаценты у недоношенных / доношенных и с ранним / поздним дебютом при малом сроке беременности: являются ли они значительными? Индийский J Pathol Microbiol. 2017 апрель-июнь; 60 (2): 232-235. [PubMed: 28631641]
- 5.
- Ohgiya Y, Nobusawa H, Seino N, Miyagami O, Yagi N, Hiroto S, Munechika J, Hirose M, Takeyama N, Ohike N, Matsuoka R, Sekizawa A, Gokan T.МРТ-изображение плода для оценки плацентарной недостаточности. Magn Reson Med Sci. 2016; 15 (2): 212-9. [Бесплатная статья PMC: PMC5600058] [PubMed: 26607809]
- 6.
- Пинтикан Д., Поенар А.А., Стрилчук С., Миху Д. Влияние курения матери на васкуляризацию плаценты человека: систематический обзор. Тайвань J Obstet Gynecol. 2019 июл; 58 (4): 454-459. [PubMed: 31307732]
- 7.
- Audette MC, Kingdom JC. Скрининг на задержку роста плода и плацентарную недостаточность. Semin Fetal Neonatal Med.2018 апр; 23 (2): 119-125. [PubMed: 29221766]
- 8.
- Башхат А.А., Харман ЧР, Гембрух У. Гематологические последствия плацентарной недостаточности. Arch Dis Child Fetal Neonatal Ed. 2004 Янв; 89 (1): F94. [Бесплатная статья PMC: PMC1721655] [PubMed: 14711871]
- 9.
- Harman CR, Baschat AA. Комплексная оценка самочувствия плода: какие допплеровские пробы следует проводить? Curr Opin Obstet Gynecol. 2003 Апрель; 15 (2): 147-57. [PubMed: 12634607]
- 10.
- Башат А.А.Реакции плода на плацентарную недостаточность: обновленная информация. BJOG. 2004 Октябрь; 111 (10): 1031-41. [PubMed: 15383103]
- 11.
- Юсуф С., Ахмад А., Кадир С., Гул С., Тали С.Х., Шахин Ф., Ахтар С., Дар Р. Использование латеральности плаценты и допплеровских аномалий маточной артерии для прогнозирования преэклампсии. J Obstet Gynaecol India. 2016 Октябрь; 66 (Дополнение 1): 212-6. [Бесплатная статья PMC: PMC5016443] [PubMed: 27651606]
- 12.
- Seyam YS, Al-Mahmeid MS, Al-Tamimi HK. Допплеровская велосиметрия пупочной артерии при ограничении внутриутробного развития и ее связь с перинатальным исходом.Int J Gynaecol Obstet. 2002 Май; 77 (2): 131-7. [PubMed: 12031563]
- 13.
- Alfirevic Z, Neilson JP. Допплерография при беременности высокого риска: систематический обзор с метаанализом. Am J Obstet Gynecol. 1995 Май; 172 (5): 1379-87. [PubMed: 7755042]
- 14.
- Kalache KD, Dückelmann AM. Допплерография в акушерстве: за пределами пупочной артерии. Clin Obstet Gynecol. 2012 Март; 55 (1): 288-95. [PubMed: 22343245]
- 15.
- Коста С.Л., Проктор Л., Додд Дж. М., Тоал М., Окун Н., Джонсон Дж. А., Виндрим Р., Королевство Дж. С..Скрининг на плацентарную недостаточность при беременности высокого риска: лучше раньше? Плацента. 2008 декабрь; 29 (12): 1034-40. [PubMed: 18930542]
Повышенные уровни PAI-1 в пуповине при плацентарной недостаточности связаны с гипоксией и ангиогенезом плода
При задержке внутриутробного развития (ЗВРП) часть беременных претерпевает нарушение регуляции кровотока плацентарных сосудов плода гипоксемия. Измененная транскрипция гипоксически регулируемого ингибитора активатора плазминогена 1 (PAI-1) была связана с осложнениями беременности и ангиогенной регуляцией.Здесь мы оценили циркулирующий PAI-1 как индикатор плацентарной недостаточности. Венозный пупочный PAI-1 гипоксемических (V p O 2 20 против 35 мм рт. Ст.) Плацентарных беременностей (индекс резистентности 0,9 против 0,63,) () сравнивали с контролем (). PAI-1 был увеличен (~ 10 раз) и имел положительный прогностический коэффициент 6,7. Кроме того, уровни PAI-1 коррелировали с кислородом крови (,). Ангиогенная активность плазмы, измеренная in vitro , была связана с уровнями PAI-1 в пуповинной крови (,).Эта ассоциация ослаблялась ингибирующим PAI-1 антителом (). Результаты демонстрируют PAI-1 как потенциальный маркер плацентарной недостаточности и идентифицируют его тесную связь с патологической гипоксией и ангиогенезом в подмножестве беременностей с ограниченным ростом.
1. Введение
Осложнение беременности, задержка внутриутробного развития (ЗВУР), встречающееся в 5–10% беременностей, является основным источником бремени нашего здравоохранения. Новорожденные с тяжелой ЗВУР (<1500 г при доношенных сроках) имеют в 70 раз больший уровень смертности.Возможно, что не менее важно, эти младенцы с ЗВУР подвержены гораздо большему риску долгосрочных хронических заболеваний, включая негативные когнитивные и поведенческие исходы, а также повышенному риску ожирения, сердечно-сосудистых и метаболических заболеваний [1–5]. Биомаркеры, связанные с патологией, могут помочь лучше предсказать тех, кто подвержен риску развития гипертонии, болезней сердца и диабета в более позднем возрасте.
В богатых обществах основной причиной ЗВУР является подгруппа пациентов, у которых у матери наблюдается недостаточный обмен газов и питательных веществ у плода, происходящий из-за нарушенной сосудистой сети плаценты.В частности, уменьшение объема сосудов и степени разветвления ворсинчатого дерева хориона увеличивает сопротивление сосудов кровотоку плодно-плацентарного кровообращения на поздних сроках беременности [6]. Это состояние, называемое плацентарной недостаточностью, приводит к замедлению или даже прекращению диастолического кровотока в пупочной артерии плода, что ставит под угрозу обмен матери / плода, вызывая гипоксемию и ацидоз плода. Таким образом, биохимическая регулирующая основа ангиогенеза при плацентарной недостаточности представляет значительный исследовательский интерес для выявления патологических механизмов.
Как ингибитор активаторов плазминогена урокиназного типа и тканевого типа, ингибитор-1 активатора плазминогена (PAI-1) уже давно участвует в возникновении тромботических заболеваний. PAI-1 является основным физиологическим ингибитором активации плазминогена в крови, который либо способствует, либо предотвращает процессы ремоделирования сосудов; PAI-1 был определен как проангиогенный фактор [7]. Существует значительная корреляция уровней циркулирующего PAI-1 с васкуляризацией опухоли и метастазами [8–10]. Повышенный уровень PAI-1 в плазме является прогностическим биомаркером неблагоприятного исхода рака груди [11–15].Он функционирует посредством регуляции внеклеточного матрикса (ЕСМ), который управляет миграцией клеток и ангиогенезом [16].
Во время беременности PAI-1 также секретируется синцитиотрофобластом, где его повышенные уровни мРНК были гистологически определены в преэкламптической плаценте с IUGR [17]. Его повышенные материнские уровни ранее были связаны с клиническими показателями кровоснабжения плода [18]. Уровни PAI-1 по разным данным были снижены [19] или не изменились [20] при беременностях с ЗВРП.Несколько исследований разделяли этиологические различия беременностей с ЗВРП, контролируемых для таких состояний, как преэклампсия, которые, хотя и имеют большое совпадение в диагностике, вероятно, являются независимой патологией [17, 20, 21] и имеют собственные регуляторные изменения PAI-1 [22 , 23]. Кроме того, PAI-1 находится ниже по течению многих регуляторных путей, включая фактор роста эндотелия сосудов A (VEGF) и фактор роста фибробластов 2 (FGF-2), которые оба участвуют в нормальном развитии сосудистой сети плаценты [24, 25].Эти цитокины, в свою очередь, сами изменяются в IUGR [26–29], предположительно влияя на экспрессию PAI-1. Наконец, открытие, что, как и VEGF, PAI-1 находится ниже элемента гипоксического ответа и, следовательно, регулируется посредством индукции, опосредованной гипоксическим индуцибельным фактором 1 (HIF-1), предполагает потенциальную связь между его экспрессией и патологией плацентарной недостаточности [30]. .
Таким образом, уровни PAI-1 в плазме при плацентарной недостаточности находятся ниже по течению от конкурирующих молекулярных регуляторных механизмов, связанных с гипоксией.Гипоксия является основным стимулом для ангиогенеза посредством передачи сигналов через индуцируемые гипоксией факторы транскрипции. Поскольку гипоксия плода варьируется от нормальной до опасной для жизни при плацентарной недостаточности, мы предположили, что уровни PAI-1 при рождении могут выступать в качестве маркера плацентарной недостаточности и, кроме того, что измененные уровни могут быть связаны с гипоксическими и ангиогенными изменениями, лежащими в основе патологии. Из ограничительной подгруппы очень тяжелых беременностей с ЗВРП, которые продемонстрировали нарушенную сосудистую сеть и плацентарную недостаточность, измеренную с помощью пупочного допплера, мы решили проверить, действительно ли PAI-1 изменяется в плацентарно-плацентарной плазме плода при плацентарной недостаточности, а также этих изменений достаточно, чтобы повлиять на ангиогенез.
2. Материалы и методы
2.1. Набор субъектов и сбор плазмы
Беременных женщин набирали с информированного согласия из больницы Св. Иосифа, Лондон, Канада, с одобрения Совета по этике исследований Университета Западного Онтарио. В исследование были включены женщины с тяжелым ЗВУР с плацентарной недостаточностью, диагностированной с помощью допплерографии пупочной артерии (). Матери с плацентарной недостаточностью в остальном были здоровы и отсутствовали из-за других серьезных осложнений беременности, чтобы свести к минимуму биологическую изменчивость, связанную с различными этиологическими факторами, лежащими в основе ЗВУР.Конкретные критерии исключения включали многоплодие, преэклампсию, отслойку плаценты, врожденные аномалии плода, инфекцию плода или плаценты и диабет матери, а также употребление наркотиков и алкоголя. Были выбраны случайным образом отобранные беременности, соответствующие гестационному возрасту, из которых также были исключены все перечисленные основные акушерские осложнения, кроме преждевременных родов. Поскольку дети с ЗВУР подвержены высокому риску заболеваемости или смертности плода, эти дети часто рождаются недоношенными. Чтобы соответствовать гестационному возрасту группы ЗВУР, мы выбрали либо нормальную массу тела при рождении для гестационного возраста, либо нормальную массу при рождении для детей гестационного возраста на сбалансированной основе.В остальном эти контрольные беременности не имели акушерских осложнений ().
У женщин с подозрением на ЗВРП оценочный вес плода был определен биометрическими ультразвуковыми измерениями плода, с расчетным весом плода значительно ниже десятого перцентиля для GA, чтобы гарантировать выбор маленьких детей для гестационного возраста, у которых было подтверждено, что вес при рождении ниже 10-го перцентиля после родов . Пупочный допплерограф измеряли максимум за три дня до родов, чтобы определить плацентарное сопротивление при беременности с ЗВУР и диагностировать плацентарную недостаточность.Поскольку при большинстве здоровых доношенных беременностей не было подозреваемых или диагностированных ЗВУР, допплеровские измерения не были показаны в течение последней недели беременности и поэтому не проводились и не абстрагировались для этого исследования. Пупочная допплерография подтвердила, что плацентарная недостаточность всех пациентов с ЗВУР была недостаточна (таблица 1). Гестационный возраст определялся по дате последней менструации матери или по длине крестца на УЗИ первого триместра. Таким образом, группы были разделены на группы с низкой массой тела при рождении с учетом их гестационного возраста или процентиля массы тела при рождении (ЗВУР определяется как <10-й процентиль) в качестве дополнительного поддиагностика плацентарной недостаточности (таблица 1).
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Сравнение средних значений проводилось методом -тестом или тестом Манна-Уитни после теста нормальности, 1). Стандартное отклонение указано в скобках. Образцы крови плода были собраны сразу после вагинального или кесарева сечения из пережатой вены пуповины путем венепункции в пробирках, покрытых ЭДТА. Значения газов в крови были измерены в клинической лаборатории, а значения взяты из карт плода. Индекс плацентарного сопротивления на последнем ультразвуковом допплеровском исследовании пуповины перед родами. У всех ИП была диагностирована сосудистая патология на основании аномально высокого индекса резистентности к ГА в дни, предшествующие родам; указаны 5 из 12 проверенных элементов управления. | ||||||||||||||||||||||||||||||||||||||||||||||||
Сразу после родов пуповина была зажата и кровь плода была извлечена из вены пуповины плода путем венепункции в пробирках, покрытых ЭДТА. Одна пробирка крови была проанализирована в больнице Св.Больница Джозефа в рамках обычной неонатальной помощи, где показатели газов крови немедленно определялись клинической лабораторией больницы с помощью анализатора газов крови Radiometer ABL 500. Вторую пробирку от того же образца центрифугировали при 3500 × g в течение 15 мин при 4 ° C, и супернатанты плазмы сохраняли для последующего анализа при -80 ° C. Затем определяли венозный и артериальный уровни кислорода из той же венепункции, что и образцы плазмы, собранные сразу после родов. Значения кислорода были взяты из карт плода.
Процентили массы тела при рождении были рассчитаны после родов с использованием стандартизованных диаграмм роста [31]. Была включена подгруппа беременностей с ЗВРП с диагнозом плацентарная недостаточность и подтвержденным ограничением роста в зависимости от массы тела при рождении. Хотя уровень ниже 10-го процентиля указывает на ЗВРП, из 18 включенных ЗВРП беременностей было подтверждено, что все, кроме 2, были ниже 3-го процентиля, и все, кроме 4, были ниже 1-го процентиля. Низкий процентиль, вероятно, отражает комбинацию выбора явных случаев ЗВУР и выделения тяжелого подтипа плацентарной недостаточности, подтвержденного пупочной допплерографией.Ограничительная подгруппа беременностей с низким процентилем ЗВРП с продемонстрированной нарушенной сосудистой сетью обеспечила выделение четкой этиологической подгруппы младенцев ЗВУР.
Все включенные контрольные беременности были> 25-го перцентиля для гестационного возраста и пола. Патологическое исследование плаценты было проведено в больнице Св. Иосифа. На основании обзора патологических отчетов и другой информации в картах пациентов, некоторые субъекты были ретроактивно исключены из-за различных медицинских осложнений, включая врожденные аномалии плода, обширные инфаркты, антенатальную гипертензию у матери или подозрение на инфекцию.Уровни газов в пуповинной крови, использованные в этой статье, также были взяты из диаграммы для 16 из 18 IUGR и 12 из 12 контролей. Образцы крови для анализа белков и газов крови были взяты одновременно и из одной венепункции в отдельные пробирки. Из-за редкости случаев, основанных на ограничительных критериях включения и исключения, были включены как вагинальные роды, так и роды путем кесарева сечения, и были оценены эффекты способа родоразрешения, а также гестационный возраст.
2.2. Культура HUVEC и ангиогенные анализы
Эндотелиальные клетки пупочной вены человека (HUVECs) (Lonza, Базель, Швейцария) выращивали в среде для роста эндотелия (Lonza), дополненной 10% FBS, с использованием колб с покрытием CELL + на поверхности роста (Sarstedt, Numbrecht, Германия). Для лечения HUVEC высевали на ECMatrix (Millipore, MA, USA) при плотности 1 × 10 4 или 3 × 10 4 клеток на лунку (96-луночный планшет) с 50 мкл мкл FBS- бесплатные СМИ. HUVEC играют важную роль в качестве модельной системы для изучения регуляции эндотелия в развитии атеросклеротических бляшек и ангиогенеза.В этом исследовании собранную плазму добавляли к эндотелиальной базовой среде (Lonza, Базель, Швейцария) (без FBS) до конечной концентрации 1% в 100 мкл л среды, чтобы определить ее влияние на образование канальцев с использованием HUVEC. Клеткам давали возможность расти в течение ~ 4-6 часов в соответствии с протоколом набора для анализа ангиогенеза in vitro (Millipore, MA, США). Для лечения ингибитором нейтрализующих антител PAI-1 мышиные антитела против PAI-1 (BD Transduction Laboratories, Франклин, Нью-Джерси, США) добавляли к плазме в 30 мкл л основной среды и инкубировали при комнатной температуре в течение 1 часа.Затем клетки добавляли в пробирки и инкубировали еще 10 минут перед посевом. С помощью инвертированного микроскопа были получены три изображения в светлом поле. Для захвата изображений использовалось программное обеспечение Leica FireCam (v3.4, Leica Microsystems, Вецлар, Германия). Длину пробирки определяли количественно с помощью программного обеспечения Axiovision (v4.7.1, Carl Zeiss, Германия), а ответвления подсчитывали вручную согласно набору для анализа ангиогенеза, как описано ранее [32].
2.3. Измерения белков и статистические оценки
Все количественные определения общего белка были выполнены методом Брэдфорда (BioRad).FGF-2, VEGF и PAI-1 были измерены с помощью иммунологических флуоресцентных мультиплексных анализов (Human CDV1, Millipore, Billerica, MA, USA) с использованием системы Bio-Plex 200 (BioRad), в которой используются флуоресцентные шарики Luminex xMAPTM. на базе технологии (Luminex Corp., Остин, Техас). Уровни были автоматически рассчитаны по стандартным кривым с использованием программного обеспечения Bio-Plex Manager (v4.1.1, BioRad). Вся статистика была сделана с использованием Prism 6 (Graph Pad Software Inc., Калифорния, США).
Для сравнения средних значений после теста использовались -тесты для параметрического теста или критерия Манна-Уитни для непараметрических данных.Односторонний дисперсионный анализ ANOVA использовался для измерения значимости нескольких средних с помощью апостериорного теста Тьюки для сравнения средних. Изменяющиеся уровни белков сравнивали с уровнями кислорода в крови, а также с другими количественными критериями, взятыми из клинических диаграмм, и степенью ангиогенеза, измеренной в ангиогенном анализе. Мультикорреляционный анализ проводился с помощью корреляционных матриц Пирсона. Для корректировки множественных сравнений был рассчитан 0,05, который считался порогом ложного обнаружения корреляционной значимости.
Кривая рабочих характеристик приемника (ROC) была определена путем сравнения групп, разделенных золотым стандартом пупочной допплеровской диагностики> 95-го процентиля индекса сопротивления пупочной артерии и подтвержденного ограничения роста, измеренного процентилем веса при рождении. Частота истинно положительных и ложноположительных прогнозов была построена и сравнена с уровнями пуповинного кислорода в крови, которые активируют PAI-1 и являются индикаторами гипоксемии и заболеваемости плода, но ненадежны, поскольку они временны и быстро меняются как маркер плацентарной недостаточности.Площадь под ROC использовалась для оценки точности прогноза, где значение выше 0,8 считалось хорошим.
3. Результаты
Образцы были собраны у маленьких для гестационного возраста детей, которые были впервые идентифицированы с помощью обычного УЗИ, отсутствия прибавки в весе и других показателей скрининга, как, вероятно, ЗВРП, возможно, вызванное плацентарной недостаточностью. Была включена подгруппа беременностей, которые впоследствии были подтверждены плацентарной недостаточностью с помощью допплерографии пупочной артерии. Поскольку большая часть этих детей с ЗВРП рождается недоношенными, чтобы свести к минимуму риск заболеваемости или смертности, они были недоношенными или доношенными контрольными, соответствующими гестационному возрасту, в качестве соответствующего контроля, сопоставимого с GA.Независимо от того, недоношенные или доношенные, контрольная группа соответствовала росту для их гестационного возраста (~ 50-й процентиль веса при рождении) по сравнению с малыми для гестационного возраста (~ 3%) (Таблица 1). Поэтому мы отделили детей с низкой массой тела при рождении, учитывая их гестационный возраст в результате плацентарной недостаточности, от тех, у которых масса тела при рождении соответствовала их гестационному возрасту (контрольная группа), независимо от преждевременных или доношенных родов (процентиль веса при рождении, таблица ).
При рождении образцы вытекающей плацентарной крови были взяты из вены пуповины.Матери, отобранные для исследования, со сроком беременности от 26,5 до 39 недель. Здоровые или часто недоношенные контрольные группы были выбраны в качестве контрольных групп, соответствующих гестационному возрасту, у которых в остальном не было осложнений. Было подтверждено, что рост младенцев с ЗВУР ограничен: процентили массы тела при рождении <10% для гестационного возраста и плаценты, весящие в среднем на ~ 125 г меньше () (Таблица 1). У всех беременностей диагностирована плацентарная недостаточность на основании допплерографии пупочной артерии. Устойчивость была аномально высокой для гестационного возраста для всех случаев ЗВУР, демонстрируя сосудистую патологию в исследуемой группе, в то время как данные были доступны только для 5 из 12 контрольных, которые все были нормальными (Таблица 1).Хотя систолическое артериальное давление у матери было несколько повышено в группе плацентарной недостаточности, общие нормальные уровни артериального давления (АД) отражают исключение субъектов с преэклампсией.
Отходящую плацентарную кровь, собранную из пуповины, анализировали на уровни PAI-1, а также на его цитокиновые регуляторы VEGF и FGF-2, используя флуоресцентный мультиплексный иммуноанализ. PAI-1 был резко повышен (~ 10 раз) при плацентарной недостаточности по сравнению с контрольной группой (рис. 1 (а)).Не было обнаружено соответствующих изменений для общего VEGF и FGF-2 (Фигуры 1 (b) и 1 (c)). Однако уровни пупочного кислорода (взятые из клинической карты плода) были значительно снижены при плацентарной недостаточности (как венозной, так и артериальной и, соответственно) (Рисунки 1 (d) и 1 (e)), что еще раз указывает на ограниченное обмен вследствие патологии сосудов плаценты.
Хотя уровни кислорода в венозной пуповинной крови значительно различались между контрольной и плацентарной недостаточностью, не было различий, связанных с режимом родоразрешения, ни в контрольной группе, ни в группах с плацентарной недостаточностью, в уровнях венозного или артериального кислорода (дополнительный рисунок 1; см. Доступный дополнительный материал. онлайн по адресу http: // dx.doi.org/10.1155/2016/7124186). Аналогичным образом, режим доставки не влиял на повышенные уровни PAI-1, VEGF и FGF-2. Уровни PAI-1 и VEGF также не менялись с возрастом беременности; однако FGF-2 снижался с возрастом гестации только в контрольной группе (дополнительный рисунок 2), что согласуется с ожиданиями [33]. Точно так же, поскольку PAI-1 активируется кортикостероидами in vitro , мы исследовали эффект субъектов, получавших стероидную терапию в качестве профилактики (<34 недель), по сравнению с теми, кто этого не делал (> 34 недель).Было обнаружено, что PAI-1 был увеличен в группе <34 недель на 42 нг / мл по сравнению с 30 нг / мл; однако это не было значительным (). Это указывает на то, что хотя и может быть некоторый эффект, он может быть потерян в более крупных изменениях, связанных с плацентарной недостаточностью.
Уровни VEGF или FGF-2, хотя и не менялись между плацентарной недостаточностью и контролем, коррелировали с повышенными концентрациями PAI-1 при контрольных беременностях (Рисунок 2 (a) (i) и (ii)). Отношения были сильно зависимыми, где () и () для VEGF и FGF-2 соответственно.Однако эта зависимость не распространялась на группу плацентарной недостаточности (рис. 2 (b) (i) и (ii)). Вместо этого, при беременностях с плацентарной недостаточностью более высокая концентрация PAI-1 в плазме зависела от уровня кислорода (,), где не было взаимосвязи в контроле (Рисунок 2 (a) (iii) по сравнению с 2 (b) (iii)) ). ROC показывает, что PAI-1 является примерно таким же чувствительным и специфическим индикатором плацентарной недостаточности, как уровень кислорода в венозной крови после родов (рис. 3). Площадь под кривой равнялась 0.847 для PAI-1 по сравнению с 0,885 для кислорода венозной пуповинной крови. Пороговое значение было определено при> 43,3 нг / мл, где PAI-1 имеет чувствительность 55,6% и специфичность 91,7%, что соответствует истинному положительному отношению правдоподобия 6,7.
PAI-1 считается ключевой молекулой при тромботических сосудистых заболеваниях, которая активируется при гипоксии. Учитывая, что PAI-1 является ангиогенным медиатором, мы измерили влияние венозной пуповинной крови на ангиогенез, используя анализ образования пробирки in vitro HUVEC.Клетки HUVEC высевали на внеклеточный матрикс и затем подвергали воздействию 1% плацентарной плацентарной недостаточности из венозной пуповины и контрольных беременностей в базальной среде. Репрезентативные изображения из анализов показаны на рисунке 4 (а). Величину ангиогенной активности плацентарной плацентарной недостаточности по сравнению с контролем сравнивали с использованием общей длины образования трубки и количества ответвлений на поле в качестве показателей с использованием стандартного набора для анализа ангиогенеза [34]. Плацентарная недостаточность индуцирована 1.В 5 раз большая длина трубки () и в 2 раза большая степень разветвления трубки () по сравнению с контрольной группой (рис. 4 (b)).
Когда степень ангиогенной индукции плазмой была коррелирована с концентрацией белков, неудивительно, что она значительно коррелировала с уровнями общего VEGF (но не FGF-2) в плазме при обоих измерениях образования трубки и разветвления ( , и, соответственно) (Рисунок 5 (a) (i)). Однако корреляция снова не перенеслась на группу плацентарной недостаточности (рис. 5 (b) (i)).Вместо этого для беременностей с плацентарной недостаточностью ангиогенная активность коррелировала с уровнями PAI-1 как для образования трубки, так и для разветвления (,, и, соответственно), где не было взаимосвязи в контроле (Рисунок 5 (a) (ii) по сравнению с 5 (b) (ii)).
Чтобы определить, связаны ли наблюдаемые ангиогенные изменения непосредственно с уровнями PAI-1, плазму пуповины от беременностей с плацентарной недостаточностью подвергали воздействию различных концентраций антитела, нейтрализующего активность PAI-1. Репрезентативные поля из анализа формирования пробирки показаны на рисунке 6 (а).Количественная оценка ингибирования показала, что изменения были значительными; 0,25 мкг мкг / мл антитела было достаточно для подавления образования трубок (), в то время как 1,25 мкг мкг / мл анти-PAI-1 ингибировали общую длину трубки и количество ветвей на поле примерно в 2 раза (и, соответственно, .) (Рис. 6 (б)), который был похож на HUVEC, выращенные в отсутствие плазмы. Результаты были воспроизведены на шести протестированных образцах плазмы из пуповины (рис. 6 (c)). Ингибирование образования трубки с помощью нейтрализующих антител вызывает участие PAI-1 в плазме пуповины в усилении ангиогенеза при плацентарной недостаточности.
4. Обсуждение
Результаты этого исследования идентифицируют PAI-1 как потенциальный маркер плацентарной недостаточности и напрямую связывают его уровни не только со степенью гипоксии, но и с изменениями ангиогенной регуляции, которые могут лежать в основе патологии. Его прогностические уровни были аналогичны уровням обычно оцениваемой гипоксии. Действительно, уровни PAI-1 были близки к степени гипоксии, но, кроме того, также были сильно связаны с ангиогенными изменениями, которые могут лежать в основе патологии.Тот факт, что уровни PAI-1 и ангиогенез, в свою очередь, связаны с гипоксией при плацентарной недостаточности, а не его молекулярные ангиогенные регуляторы VEGF и FGF-2, указывает на то, что повышающая регуляция может происходить в значительной степени через механизмы, опосредованные HIF-1. Ингибирование PAI-1 ослабляло плазменную стимуляцию образования трубок дозозависимым образом, демонстрируя центральное значение PAI-1 для ангиогенеза как фактора циркуляции. Учитывая известную значительную роль PAI-1 в ангиогенезе и его роль в качестве клинического биомаркера васкуляризации опухоли, чрезмерная регуляция (~ 10-кратная) PAI-1 в плазме может иметь очень важные последствия для регуляции сосудов в плаценте. .Эти данные подтверждают ключевую роль PAI-1 в патофизиологии ЗВУР. Кроме того, результаты обеспечивают основу для оценки уровней PAI-1 для использования в качестве маркера плацентарного заболевания после родов у новорожденных, у которых определено ЗВУР.
Газы крови после родов обычно используются для оценки ацидоза или алкалоза при родах, которые могут быть острыми. В этом исследовании пациенты были признаны недостаточными по родителям, а наблюдаемые пониженные уровни кислорода в пуповине и высокий уровень углекислого газа в большинстве случаев отражают сильно сниженный обмен в плаценте.Венозная пуповина p O 2 при измерении приближается к уровню плацентарного кислорода, коррелируя 0,80 с уровнем плаценты [35]. Известно, что экспрессия PAI-1 активируется VEGF и FGF-2 [16]. Уровни обоих этих цитокинов в плазме сильно коррелировали с уровнями PAI-1 (Рисунок 2 (a) (i) и (ii)) (которые, в свою очередь, были сильно связаны с ангиогенной активностью (Рисунок 5 (a))), однако , только для элементов управления. При нормальной беременности экспрессия ангиогенных цитокинов вполне может быть ответственной за наибольшую степень экспрессии PAI-1 и ее соответствующее влияние на ангиогенез.
Удивительно, что VEGF не увеличивался в условиях гипоксии или плацентарной недостаточности, и его уровни не коррелировали со степенью гипоксии в крови (данные не показаны). Предыдущие исследования в разной степени сообщали о том, что плацентарная экспрессия VEGF увеличивалась [27, 36], уменьшалась или не изменялась в IUGR [37, 38]. Было высказано предположение, что плацентарная недостаточность может приводить к гипероксии, локализованной на ворсинах плаценты [39, 40], что может ограничивать или снижать экспрессию VEGF из слоя ворсинчатого трофобласта [41–43].Неизвестно, регулирует ли фактор роста плаценты (PlGF), который увеличивается в кровотоке в условиях беременности с хорошей оксигенацией, активную регуляцию PAI-1, хотя вполне вероятно, что это происходит через связывание рецептора 1 фактора роста эндотелия сосудов (FLT-1) [44].
PAI-1, как и VEGF, также напрямую активируется с помощью HIF-1 при гипоксии [30], и уровни PAI-1 действительно увеличивались очень значительно в корреляции со снижением уровней венозного кислорода (Рисунок 2 (b) (iii)) в Плацентарная недостаточность при беременности.Эта связь с кислородом и отсутствие связи с регуляторными цитокинами при плацентарной недостаточности предполагает, что наблюдаемое значительное увеличение уровней PAI-1 может быть связано с прямой транскрипцией, опосредованной HIF-1. Точно так же отсутствие сильной связи с кортикостероидами предполагает, что, хотя введение кортикостероидов для содействия созреванию легких при тяжелой преждевременной беременности может иметь некоторое влияние на фетоплацентарную экспрессию PAI-1, в нашей когорте не наблюдалось значительных различий.Кроме того, изменения не были настолько значительными, чтобы предполагать, что они замаскируют 10-кратное среднее изменение, наблюдаемое при плацентарной недостаточности. Тем не менее, исследования экспрессии PAI-1 должны учитывать введение кортизона в качестве потенциального фактора, влияющего на маркер тяжелой преждевременной беременности.
Проангиогенное действие PAI-1, как предполагается, осуществляется за счет модификации баланса деградации плазмина в ЕСМ, обеспечивая стабильную платформу ЕСМ для миграции, пролиферации и созревания сосудов [45].Кроме того, он выполняет функцию связывания витронектина, которая может блокировать связывание эндотелиальных интегринов при миграции клеток [46]. Мыши, лишенные экспрессии PAI-1, предотвращают инвазию и васкуляризацию трансплантированных злокачественных опухолей [8]. Он необходим для ангиогенеза постишемического повреждения сетчатки в мышиной модели ангиогенеза [7]. Недавние исследования показали, что мыши с нокаутом PAI-1 временно уменьшили материнскую и плодно-плацентарную сосудистую сеть [47].
Диапазон PAI-1 составлял ~ 1–50 нг / мл при нормальной беременности, обычно <10 нг / мл.При гипоксической плацентарной недостаточности он составлял в среднем ~ 50 нг / мл и был в 3 раза выше (рис. 1 (а)). В соответствии с этим, наилучшее разделение, определенное по ROC, составило 43,3 нг / мл. В контексте, уровни циркулирующего PAI-1 в диапазоне от 50 нг / мл или выше представляют собой значительное отклонение от нормальных физиологических уровней, которые могут влиять на функцию. Действительно, уровни PAI-1 были сильно связаны с ангиогенезом (фиг. 5 (b) (ii)), и его ингибирование было достаточным, чтобы в значительной степени обратить вспять индуцированный плазмой ангиогенез in vitro (фиг. 6).Эффекты почти полного ингибирования PAI-1 не отличаются от некоторых контрольных беременностей, которые были <1 мк мкг / мл. Циркулирующие концентрации> 30 нг / мл обладают значительным физиологическим эффектом, по сравнению с которым почти в три раза выше риск смерти от рака груди [48]. PAI-1 тесно связан с васкуляризацией опухоли, где его повышенные уровни связаны с плохим прогнозом [9, 10, 13]. Сосудистые состояния плода-плаценты на поздних сроках беременности при плацентарной недостаточности аналогичны состояниям при некоторых опухолях молочной железы в том, что имеют место сосудистая дисрегуляция, воспаление, гипоксия и измененная регуляция VEGF и других генов через HIF-1 [49].
ЗВУР имеет множественную этиологию, и строгость исключения неидиопатической плацентарной недостаточности и других осложнений нашего отбора пациентов (подробно описанных в Разделе 2) является важнейшим преимуществом этого исследования. Изученные образцы представляют собой наиболее тяжелые случаи ЗВУР с очень низким процентилем массы тела при рождении и были критически проверены на наличие значительно повышенного индекса резистентности для гестационного возраста, включая только подтвержденные сосудистые мальформации, которые являются признаком плацентарной недостаточности (Таблица 1) [50, 51 ].Хотя в большинстве контрольных групп не проводилась допплеровская оценка плацентарной недостаточности, отсутствие каких-либо указаний на ЗВУР, определяемых обычным ультразвуком и регулярным обследованием высоты дна матки симфиза и подтвержденных процентильной оценкой массы тела при рождении, исключает возможность аномального доплеровского обнаружения в контрольной группе, поскольку действительно, эти тесты не были показаны с медицинской точки зрения этим пациентам. По этой причине можно было уверенно определить Китайскую республику по отношению к «золотому стандарту». Это не только помогло выделить типовой случай, в котором можно было ожидать наибольших изменений, но и снизило вероятность включения нормальных процентильных случаев из-за неточностей в расчетном гестационном возрасте.Контроли были выбраны на основе соответствия гестационному возрасту для общего эффекта очень хорошо контролируемой группы исследования тяжелой идиопатической ЗВУР с плацентарной недостаточностью. Однако следует учитывать молекулярные эффекты увеличения количества спонтанных преждевременных родов в контрольной группе по сравнению с показанными преждевременными родами при плацентарной недостаточности. Обзор литературы не предлагает убедительных связей между изменением уровней PAI-1 в плазме и началом родов, хотя он участвует в протеолитических событиях в децидуальной оболочке.
И наоборот, строгие критерии исключения могли направить усилия по сбору на наиболее очевидные случаи плацентарной недостаточности, которые потенциально могут быть более серьезными, чем в среднем, что может повлиять на истинную прогностическую ценность PAI-1. Плацентарная недостаточность является одной из самых тяжелых из этиологий, сравнение между большими когортами смешанной этиологии лучше всего определит ее прогностическую ценность. Тем не менее, 10-кратное среднее отделение PAI-1 от контроля и сильная корреляция с патологическими факторами, такими как гипоксия, являются убедительными показателями его потенциальной специфичности.Наконец, наши измерения PAI-1 обязательно были послеродовыми. Поскольку генез патологии может начаться в основном между 7 и 25 неделями [52], наши эксперименты, вероятно, фиксируют эффекты, но не причины сужения или сокращения сосудистой сети. В какой степени серьезные изменения PAI-1 инициируют патологию, поэтому остается без оценки.
Для развития опухоли было продемонстрировано, что повышенный уровень циркулирующего PAI-1 имеет важное значение в качестве биомаркера даже в пределах нормального физиологического диапазона.Его прогностическая ценность связана с его функцией в качестве центрального ангиогенного медиатора. Здесь мы обнаружили, что уровни циркулирующего PAI-1 в венозной пуповинной крови сильно повышены и тесно связаны с гипоксемией, вызванной сосудистой патологией плацентарной недостаточности. Уровни напрямую коррелировали с повышенной ангиогенной активностью плазмы. Хотя в условиях, ограничивающих метаболический субстрат, изменения уровней циркулирующего белка могут быть адаптивными [53–55], предполагается, что PAI-1 может вносить вклад в патологию сосудов при плацентарной недостаточности, способствуя сосудистому сопротивлению.Таким образом, наши результаты определяют потенциальную полезность PAI-1 в качестве постнатального маркера плацентарной болезни. Его клиническое использование может дополнять существующие измерения газов крови, которые скорее указывают на острый ацидоз, чем на функцию плаценты как таковую .
5. Выводы
PAI-1 позволяет прогнозировать плацентарную дисфункцию при плацентарной недостаточности. Его уровни сильно связаны с гипоксией, где он может напрямую повышаться с помощью механизмов, опосредованных HIF-1. Повышенные уровни PAI-1 в плазме способствуют усилению ангиогенных механизмов.Большая проспективная когорта, сравнивающая уровни PAI-1 вместе с результатами допплерографии пупочной артерии, определит его полезность при ретроспективной идентификации пациенток, родившихся после беременности с плацентарной дисфункцией, для этиологической классификации ЗВУР.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Эта работа была частично поддержана грантом Института исследований здоровья Лоусона, Университет Западного Онтарио (UWO), Канада, Мадхулика Б.Гупта. Максим Д. Сеферович является стипендиатом Канадского совета по естественным наукам и инженерным исследованиям (NSERC), стипендии Александра Грэма Белла для аспирантов в Канаде. Максим Д. Сеферович также благодарит Департамент педиатрии (UWO) за получение стипендии для аспирантов.
Дополнительные материалы
Мы стремились определить, связаны ли наблюдаемые изменения в белках пуповинной крови с началом родов или гестационным возрастом младенца. Никаких значительных изменений не наблюдалось для PAI-1, VEGF или FGF-2 в связи с родами ни в одной из групп.Точно так же уровень кислорода в пуповине у наших испытуемых не изменился (дополнительный рисунок 1). Также не было изменений в PAI-1 или VEGF, связанных с GA. Наблюдалась значительная отрицательная корреляция FGF-2 с GA для контроля, которую нельзя было увидеть у пациентов с IUGR (дополнительный рисунок 2). Ранее сообщалось, что FGF-2 постепенно снижает кровообращение плода после 20 недель нормальной беременности (Hill et al., 1995).
Хилл, Д.Дж., Теваарверк, Г.Дж., Арани, Э., Килкенни, Д., Грегори, М., Лэнгфорд, К.С., и Миелл, Дж. (1995). Фактор роста фибробластов-2 (FGF-2) присутствует в сыворотке крови матери и пуповины, а в сыворотке крови матери связан со связывающим белком, иммунологически связанным с рецептором FGF-1. J. Clin. Эндокринол. Метаб . 80: 1822–1831.
- Дополнительные материалы
Frontiers | Реакции плаценты на изменения в окружающей среде матери определяют рост плода
Введение
Неблагоприятное влияние матери во время беременности связано с изменениями во внутриутробной среде, которые связаны с краткосрочными осложнениями, включая изменение роста плода и повышенную перинатальную заболеваемость, а также с долгосрочными неблагоприятными последствиями для здоровья потомства.Эта концепция эмбрионального программирования или развития происхождения здоровья и болезни (Forsdahl, 1977; Barker and Osmond, 1986; Barker et al., 1989; Hales et al., 1991; Ravelli et al., 1998; Armitage et al., 2004) ; Gluckman and Hanson, 2004) предполагает, что успешная профилактика метаболических заболеваний у взрослых зависит от вмешательства во время беременности.
Плацента воспринимает изменения в окружающей среде матери и реагирует на них, изменяя ее структуру и функции, что может привести к изменениям кровотока, питания плода и секреции гормонов и других сигнальных молекул.Изменения в трансплацентарном транспорте питательных веществ могут влиять на доступность питательных веществ для плода, которая определяет рост плода и состав тела, и, таким образом, может связывать материнские нарушения с программированием плода.
Механизмы, с помощью которых измененная материнская среда во время беременности может привести к заболеванию у потомства, плохо изучены. Здесь мы обсуждаем материнские циркулирующие факторы, которые регулируют функцию плаценты, и подчеркиваем роль плацентарной механистической мишени передачи сигналов рапамицина (mTOR) как сигнального пути чувствительности к питательным веществам плаценты, который изменяет перенос питательных веществ в плаценту в ответ на множество факторов.
Определение питательных веществ в плаценте
Модель для определения питательных веществ в плаценте предполагает, что синцитиотрофобласт интегрирует сигналы матери и плода для регулирования функции плаценты. Модель подчеркивает важность изменений в материнском компартменте (Gaccioli et al., 2013; Jansson and Powell, 2013), на которые плацента реагирует, сопоставляя рост плода со способностью материнской линии снабжения распределять ресурсы плоду. Материнские сигналы, которые предоставляют информацию плаценте, могут включать метаболические гормоны, уровни питательных веществ и кислород.В условиях нарушенной способности материнского источника питания доставлять питательные вещества и кислород к плаценте функции плаценты, включая трансплацентарный транспорт питательных веществ и рост плаценты, могут быть подавлены, что напрямую способствует замедлению роста плода. Напротив, в условиях избыточного питания чувствительность плаценты к питательным веществам может привести к усилению функции плаценты, что напрямую способствует чрезмерному росту плода (рис. 1).
Рис. 1. Модель для определения питательных веществ в плаценте.Плацента объединяет материнские сигналы с информацией от сигнальных путей, воспринимающих питательные вещества, таких как механическая мишень рапамицина (mTOR), для регулирования функции плаценты. В результате рост плода соответствует способности материнской линии снабжения выделять ресурсы плоду. Таким образом, реакция плаценты на материнские сигналы влияет на рост плода и долгосрочное здоровье потомства.
Плацентарный барьер
Синцитиотрофобласт, транспортный и производящий гормоны эпителий плаценты, представляет собой первичный барьер для обмена между матерью и плодом.Синцитиотрофобласт представляет собой поляризованный эпителий с обращенной к матери микроворсинкой плазматической мембраной (MVM) и обращенной к плоду базальной плазматической мембраной (BM). MVM и BM имеют различные биологические характеристики, включая различный состав мембран и их экспрессию переносчиков питательных веществ. Экспрессия и функция этих переносчиков питательных веществ влияет на способность плаценты передавать питательные вещества от матери к плоду, что является важным фактором, определяющим рост плода.
Было показано, что материнские факторы, включая гормоны, факторы роста и некоторые цитокины, регулируют трансплацентарный транспорт питательных веществ.Инсулин (Jansson et al., 2003; Roos et al., 2009), инсулиноподобный фактор роста I (IGF-I; Fang et al., 1997; Roos et al., 2009), лептин (Jansson et al., 2003), интерлейкин-6 (IL-6; Jones et al., 2009a) и фактор некроза опухоли альфа (TNF-α; Jones et al., 2007) положительно регулируют систему A, транспортную систему, которая опосредует несущественные нейтральные поглощение аминокислот (АК). Рецепторы многих гормонов, включая IGF-I, инсулин и лептин, также присутствуют в MVM (Desoye et al., 1994; Fang et al., 1997; Ebenbichler et al., 2002), предполагая, что материнские гормоны регулируют функцию трофобластов. Концентрации материнского IGF-I в сыворотке (Holmes et al., 1997) и лептина (Yildiz et al., 2002) снижаются при задержке внутриутробного развития (IUGR), в то время как беременность, связанная с ожирением и диабетом, имеет более высокий уровень IGF-I в материнской сыворотке, инсулина. и лептин (Lauszus et al., 2001; Jansson et al., 2008). Это говорит о том, что материнские факторы могут регулировать активность и экспрессию белков-транспортеров в синцитиотрофобласте, что может влиять на рост и здоровье плода.
Разнообразные материнские сигналы воздействуют на плаценту
Широкий спектр материнских факторов воздействует на плаценту, предоставляя важную информацию о способности материнского источника питания поддерживать беременность (Jansson et al., 2012; Gaccioli et al., 2013; Jansson and Powell, 2013; Díaz et al. ., 2014).
Utero -Плацентарный кровотокРазвитие некоторых осложнений беременности, в частности ЗВУР и преэклампсии, связано с нарушением utero -плацентарного кровотока.Нарушение utero -плацентарного кровотока может вызвать «плацентарную недостаточность», то есть нарушение снабжения плода питательными веществами и кислородом. Часто предполагается, что плацентарная недостаточность возникает только из-за снижения плацентарного кровотока (Krishna and Bhalerao, 2011). Однако уменьшение плацентарного кровотока само по себе не может адекватно объяснить нарушение плацентарного переноса при ЗВУР. Например, основным ограничивающим фактором трансплацентарного транспорта питательных веществ, таких как глюкоза и АК, является их транспорт через синцитиотрофобласт.Мы предположили, что плацента чувствует снижение кровотока или, возможно, гипоксию, и реагирует подавлением ключевых переносчиков питательных веществ в плаценте, что напрямую способствует ЗВУР. Более того, плацента IUGR имеет уменьшенный объем межворсинчатого пространства, плохо развитые периферические ворсинки и более толстый трофобластный эпителий, что уменьшает площадь обмена питательных веществ и ставит под угрозу обменные функции плаценты (Burton, 2010).
Модели на животных с нарушением utero -плацентарного кровотока демонстрируют снижение способности плацентарного транспорта питательных веществ.Трансплацентарный транспорт глюкозы и АК был снижен в IUGR после перевязки маточной артерии у крысы (Nitzan et al., 1979), однако активность системы A MVM in vitro (Glazier et al., 1996) и плацентарная экспрессия переносчиков глюкозы GLUT 1 и GLUT 3 (Reid et al., 1999) не пострадали. У морских свинок IUGR, индуцированный односторонней перевязкой артерии, был связан со снижением трансплацентарного транспорта AA (Jansson and Persson, 1990). В модели ЗВУР овцы, вызванной гипертермией матери и снижением матки, -плацентарного кровотока, трансплацентарный транспорт лейцина (Ross et al., 1996), треонин (Anderson et al., 1997), глюкоза (Thureen et al., 1992) и ACP (аналог АК с разветвленной цепью) (de Vrijer et al., 2004) были восстановлены.
В человеческих IUGR, связанных с уменьшением utero -плацентарного кровотока, активность нескольких плацентарных переносчиков AA снижена, тогда как экспрессия и активность плацентарного GLUT1 не затрагиваются (Jansson et al., 1993, 2002b). Активность системы A постоянно ниже в MVM, выделенном из плаценты IUGR (Mahendran et al., 1993; Glazier et al., 1997), особенно при недоношенных ЗВР (Jansson et al., 2002b), и связано со степенью компрометации плода (Glazier et al., 1997). Точно так же активность переносчиков основных АК, включая систему β (таурин) и систему L (лизин и лейцин), снижается в MVM и / или BM плаценты IUGR (Jansson et al., 1998; Norberg et al., 1998 ), что согласуется с уменьшением плацентарного переноса незаменимых кислот лейцина и фенилаланина, наблюдаемого in vivo при беременностях с ЗВРП в срок (Paolini et al., 2001). Снижение трансплацентарного транспорта АК к плоду может объяснить низкие уровни некоторых АК в плазме у плодов с задержкой роста (Economides et al., 1989; Cetin et al., 1990). Активность липопротеинлипазы (LPL), фермента, ответственного за гидролиз липопротеинов, снижена в MVM плаценты IUGR (Magnusson et al., 2004). IUGR также связан со сниженной плацентарной экспрессией липопротеиновых рецепторов, липопротеинов низкой плотности (LDL) и рецепторов скавенджера класса B типа I, ключевых рецепторов для захвата холестерина из материнских LDL и / или HDL (Wadsack et al., 2007). Таким образом, плацентарный транспорт липидов может быть нарушен при IUGR, возможно, способствуя уменьшению запасов липидов в IUGR плода (Padoan et al., 2004). В совокупности эти данные предполагают, что эффект снижения utero -плацентарного кровотока на рост плода частично опосредован сниженной способностью к переносу питательных веществ через плаценту.
Гипоксия
Несмотря на компенсаторные механизмы, такие как полицитемия плода, трансплацентарный перенос кислорода снижается при материнской гипоксии, что обычно связано с ЗВУР (Giussani et al., 2007). Женщины, проживающие на большой высоте с пониженным кислородным напряжением, имеют более высокий риск рождения детей с ЗВУР, чем женщины, живущие на уровне моря (Zamudio and Moore, 2000; Mehta and Mehta, 2008). Нельсон и др. Сообщили, что гипоксия вызывает снижение экспрессии и активности транспортера системы А в культивируемых первичных клетках трофобласта человека (Nelson et al., 2003), предполагая, что адекватное снабжение кислородом важно для функции транспортеров питательных веществ. Кроме того, высокогорная гипоксия снижает экспрессию GLUT1 в плазматической мембране синцитиотрофобластов (Zamudio et al., 2006).
Материнские гормоны
Материнские гормоны могут влиять на здоровье плода, изменяя функцию плаценты (Fowden et al., 2015). Материнский IGF-I способствует поглощению и транспорту питательных веществ через плаценту (Sferruzzi-Perri et al., 2011a). В моделях ЗВУР на животных повышение концентрации материнского IGF улучшало рост плода (de Boo et al., 2008). Острая терапия IGF-I у матери на поздних сроках беременности связана с усилением доставки глюкозы к плоду (Liu et al., 1994). Это также наблюдалось на мышиной модели IUGR, где экспрессия плацентарного переносчика глюкозы увеличивалась после внутриплацентарной инъекции опосредованного аденовирусом IGF-I (Jones et al., 2013) восстановления веса плода (Keswani et al., 2015). В трофобластах человека IGF-I увеличивает экспрессию GLUT1 (Baumann et al., 2014) и стимулирует опосредованное глюкозой и системой А поглощение АК (Karl, 1995; Roos et al., 2007). Кроме того, сниженный уровень циркулирующего IGF-I у матери связан с малым для гестационного возраста младенцами с задержкой роста (Hernandez-Valencia et al., 2001). Уровни белка рецептора IGF-I были снижены при ЗВУР (Laviola et al., 2005) и повышены при беременности, осложненной макросомией (Jiang et al., 2009).
Инсулин и лептин стимулируют активность плацентарной системы А (Karl et al., 1992; Jansson et al., 2003; von Versen-Hoynck et al., 2009), в то время как адипонектин ингибирует стимулируемый инсулином транспорт AA (Jones et al., 2010; Rosario et al., 2012; Aye et al., 2014a, 2015). Введение материнских кортикостероидов беременным мышам в середине беременности снижает транспорт А плацентарной системы (Audette et al., 2011), что приводит к снижению веса плода (Vaughan et al., 2012). Следовательно, материнские гормоны влияют на рост плода, изменяя активность плацентарных переносчиков питательных веществ и плацентарную секрецию гормонов (Sferruzzi-Perri et al., 2011а).
Материнское питание
Рост плода в значительной степени зависит от питания матери и, как полагают, частично опосредован изменениями в метаболизме и уровне гормонов матери.
В модели ограничения материнского белка на крысах уровни материнского инсулина, IGF-I и лептина были снижены (Rosario et al., 2011), и аналогичные изменения наблюдались в модели ограничения калорийности мышей (Sferruzzi-Perri et al., 2011b). Уровни материнского кортикостерона также были увеличены в этой модели мышей (Sferruzzi-Perri et al., 2011б). Напротив, беременные мыши на диете с высоким содержанием жиров показали повышенный уровень материнского лептина и пониженный уровень адипонектина (Jones et al., 2009b). В соответствии с этими наблюдениями, уровни материнского инсулина и лептина были повышены у беременных мышей с ожирением, соблюдающих диету с высоким содержанием жиров и сахара (Rosario et al., 2015b).
Эндокринные и метаболические изменения матери в ответ на изменение питания одинаковы у экспериментальных моделей и у женщин. В человеческих IUGR концентрации материнской сыворотки IGF-I, инсулина и лептина снижены (Jansson et al., 2006), в то время как беременные женщины с ожирением и беременность, осложненная гестационным диабетом, имеют более высокие уровни лептина, инсулина, IGF-I и снижение уровня адипонектина (Lauszus et al., 2001; Jansson et al., 2008; Aye et al. , 2013а, 2015).
Поскольку гормональная регуляция транспорта питательных веществ через плаценту хорошо известна, одним из ключевых механизмов, с помощью которого питание матери изменяет функцию плаценты и рост плода, может быть регулирование транспорта питательных веществ через плаценту. В соответствии с этой гипотезой, различные экспериментальные модели недостаточного питания матерей на животных показывают снижение транспорта питательных веществ через плаценту.Например, ограничение материнской калорийности у бабуина вызвало ЗВУР и показало снижение экспрессии и активности in vitro ключевых переносчиков АК, снижение in vivo, трансплацентарного транспорта АК, а также более низкие уровни незаменимых АК у плода (Kavitha et al., 2014 ; Pantham et al., 2015b). Ограничение калорийности у мышей привело к снижению трансплацентарного транспорта глюкозы и лейцина (Ganguly et al., 2012). У крыс ограничение калорий или белка на поздних сроках беременности снижает нейтральные АК и трансплацентарный транспорт глюкозы (Rosso, 1977a, b; Malandro et al., 1996; Янссон и др., 2006; Росарио и др., 2012). Таким образом, предполагаемая причинно-следственная связь между недостаточным питанием матери и замедлением роста плода включает хорошо известную физиологическую гормональную реакцию на голодание. В частности, прогнозируется, что повышение уровней катаболических гормонов, таких как кортизол, и снижение анаболических гормонов, включая инсулин и IGF-I, ингибируют перенос питательных веществ через плаценту, что приводит к снижению доступности питательных веществ для плода и ЗВУР. Сообщалось о противоположных ответах плаценты при избыточном питании матери в сочетании с чрезмерным ростом плода.В модели материнского ожирения у мышей, экспрессия и активность глюкозы in vitro, и транспортера АК и активность in vivo, трансплацентарный транспорт глюкозы и АК увеличиваются (Aye et al., 2015; Rosario et al., 2015b). Важно отметить, что эти результаты согласуются с повышением регуляции плацентарного транспорта АК у тучных женщин, рожающих крупных детей (Jansson et al., 2013), и повышенной способности плаценты транспортировать АК и глюкозу у женщин с диабетом и чрезмерным ростом плода (Jansson et al. ., 1999, 2002а).
Медиаторы воспаления
Измененный воспалительный профиль матери, плаценты или плода может повлиять на функцию плаценты. В частности, было высказано предположение, что системное воспаление у матери играет роль в программировании развития метаболических нарушений, особенно при беременности, осложненной ожирением и гестационным диабетом (Ingvorsen et al., 2015; Pantham et al., 2015a). У потомков самцов самок, которым вводили липополисахарид в середине беременности, наблюдалось повышенное потребление пищи, увеличивалась масса тела и увеличивалась брюшная жировая ткань с пониженным потреблением инсулина, что соответствовало развитию ожирения и инсулинорезистентности (Nilsson et al., 2001). Потомство самок, подвергшихся воздействию высоких системных уровней TNF-α или IL-6, демонстрировало повышенную массу тела и ожирение, а воздействие одного только IL-6 приводило к инсулинорезистентности у потомства женского пола (Dahlgren et al., 2001).
Материнское ожирение у женщин связано с системным воспалением матери низкой степени и признаками воспаления плаценты (Challier et al., 2008). Ранняя беременность у полных женщин была сопоставима с таковой у матерей с нормальным весом в конце беременности (Ingvorsen et al., 2014), предполагая ослабление воспалительного состояния матери у тучных женщин с опережающим сроком беременности. Точно так же у женщин с высоким ИМТ наблюдались повышенные уровни циркулирующих MCP-1 и TNF-α и активация воспалительных путей плаценты p38-MAPK и STAT3 (Aye et al., 2014b) без признаков воспаления плода, что позволяет предположить, что воспаление связано с избыточным весом матери. / ожирение влияет на плод косвенно, модулируя функцию плаценты.
Циркулирующие цитокины матери могут влиять на функцию плаценты, изменяя экспрессию и активность плацентарных переносчиков питательных веществ.Было показано, что IL-6 и TNF-α стимулируют активность системы A в культивируемых первичных трофобластах человека (Jones et al., 2009a). Напротив, IL-1β снижает активность системы A в клетках BeWo (Thongsong et al., 2005) и ингибирует стимулируемую инсулином активность системы A в культивируемых первичных трофобластах (Aye et al., 2013b). В совокупности эти данные предполагают, что низкосортное системное воспаление у матери при материнском ожирении влияет на рост плода и программирует плод на будущие заболевания, изменяя функции плаценты, такие как транспорт питательных веществ.Еще предстоит установить, способствует ли прямое воздействие на плод медиаторов воспаления.
Плацентарная малярия и ЗВУР
Ежегодно около 85 миллионов беременных женщин подвергаются риску заболевания малярией, что приводит к примерно 600000 родов с низкой массой тела (Steketee et al., 2001; Desai et al., 2007), главным образом, за счет ЗВУР (Guyatt and Snow, 2004). Недавние исследования показывают, что подавление транспорта питательных веществ через плаценту может способствовать развитию ЗВУР, связанной с малярией (Boeuf et al., 2013; Chandrasiri et al., 2014).
Плацентарная малярия – это секвестрация эритроцитов, инфицированных Plasmodium falciparum , в межворсинчатом пространстве плаценты (Boeuf et al., 2013). Эта секвестрация может стимулировать рекрутирование материнских воспалительных клеток, таких как моноциты и макрофаги, состояние, называемое интервиллозитом (Ordi et al., 1998), которое связано с повышенным риском родов с низкой массой тела (Desai et al., 2007; Rogerson et al., др., 2007).
Секвестрированные мононуклеарные клетки и синцитиотрофобласт могут продуцировать различные цитокины и хемокины.При плацентарной малярии межворсинчатые уровни в плазме IFN-γ и TNF-α, IL-10 и MCP-1 увеличиваются (Rogerson et al., 2003; Suguitan et al., 2003). Межворсинчатый плазменный MIP-1α, IL-8 и привлекающие моноциты бета-хемокины, такие как CCL2 и CCL3, также увеличиваются при плацентарной малярии с интервиллозитом (Abrams et al., 2003; Bouyou-Akotet et al., 2004; Ioannidis et al. ., 2014). Воспаление может нарушить развитие и функцию плаценты, способствуя ЗВУР при плацентарной малярии. Кроме того, у женщин с плацентарной малярией, особенно с интервиллозитом, наблюдались пониженные уровни циркулирующего IGF-I у матери (Umbers et al., 2011). Уровни материнского лептина были снижены у матерей с плацентарной малярией (Kabyemela et al., 2008). Важно отметить, что плацентарная малярия с интервиллозитом связана с нарушением поглощения плацентарной АК (Boeuf et al., 2013) и экспрессии BM GLUT-1 (Chandrasiri et al., 2014). Таким образом, воспаление в большей степени, чем инфекция, связано со снижением функции транспорта питательных веществ через плаценту и нарушением регуляции материнских гормонов, что может повлиять на рост и развитие плода. Механизмы, лежащие в основе сниженной способности плацентарного транспорта питательных веществ и ЗВУР при плацентарной малярии, еще предстоит полностью установить.
Сигнализация mTOR при обнаружении питательных веществ в плаценте
Клетки млекопитающих имеют ряд сигнальных путей, чувствительных к питательным веществам, таких как AMP-активируемая протеинкиназа (AMPK), путь передачи сигнала ответа AA, гликогенсинтаза-3 (GSK-3), mTOR и путь передачи сигналов гексозамина, которые регулируют метаболизм клеток в ответ на изменение уровня питательных веществ. Считается, что из них mTOR играет центральную роль в восприятии питательных веществ плацентой (Jansson and Powell, 2006; Jansson et al., 2012).mTOR существует в виде двух белковых комплексов: mTOR Complex 1 (mTORC1), который регулирует рост, пролиферацию и метаболизм клеток, и mTORC2, который регулирует организацию цитоскелета и клеточный метаболизм. Плацентарная передача сигналов mTOR, вероятно, составляет критическую связь между кислородом и питательными веществами матери и ростом плода (Jansson et al., 2012).
Гипоксия подавляет передачу сигналов mTORC1 за счет повышенной экспрессии ответа на повреждение ДНК 1 (REDD1; Brugarolas et al., 2004) и за счет активации AMPK (Inoki et al., 2003). Yung и соавторы также сообщили, что плацентарная передача сигналов mTORC1 ингибируется у женщин, проживающих на большой высоте, что согласуется с концепцией, что гипоксия ингибирует плацентарную передачу сигналов mTORC1 (Yung et al., 2008). Кроме того, на активность плацентарного сигнального пути mTOR влияет множество вышестоящих регуляторов, таких как аминокислоты, факторы роста и свободные жирные кислоты, на которые, вероятно, влияет питание матери. Ограничение белка у крыс (Jansson et al., 2006) и ограничение питательных веществ у бабуинов (Kavitha et al., 2014) привело к ингибированию плацентарной активности mTORC1, что согласуется с IUGR человека (Roos et al., 2007; Yung et al., 2008; Chen et al., 2015). Напротив, плацентарный mTOR активируется на животных моделях материнского ожирения (Jones et al., 2009b; Rosario et al., 2015b) и у тучных женщин, рожающих крупных детей (Jansson et al., 2013).
mTOR также играет ключевую роль в регуляции переносчиков АК в плаценте человека. In vitro , mTORC1 положительно регулирует систему A и систему L, критически важную для трансплацентарного транспорта АК (Rosario et al., 2013). mTORC1 регулирует клеточный захват АК, воздействуя на перенос переносчиков через плазматическую мембрану путем дифференциального убиквитинирования, возможно, посредством убиквитинлигазы, NEDD4-2 (Rosario et al., 2013, 2015a; Chen et al., 2015).
Мы предполагаем, что mTOR функционирует как ключевой сигнальный путь определения питательных веществ в плаценте, отвечая на вышестоящие материнские сигналы, модулируя трансплацентарный транспорт AA и влияя на перенос переносчиков питательных веществ (Рисунок 2).
Рисунок 2.Плацентарный mTOR как сигнальный путь восприятия питательных веществ . mTOR объединяет материнские сигналы, такие как питательные вещества и факторы роста, чтобы модулировать перенос питательных веществ от материнского кровообращения к эмбриону. mTORC1 модулирует перенос транспортеров AA, возможно, посредством дифференциального убиквитинирования, опосредованного NEDD4-2. Ингибирование NEDD4-2 приведет к увеличению локализации переносчиков АК в плазматической мембране (Rosario et al., 2013, 2015a; Chen et al., 2015).
Заключение и перспективы
Изменения в материнской среде могут нарушить рост и развитие плода, что может привести к повышенной восприимчивости к заболеваниям в послеродовом периоде.Мы предположили, что чувствительность к питательным веществам в плаценте позволяет плаценте интегрировать эти нарушения с информацией из внутренних сигнальных путей определения питательных веществ, чтобы регулировать секрецию гормонов и перенос питательных веществ и кислорода через плаценту. Поскольку снабжение плода питательными веществами программирует плод на будущее, функция плаценты определяет рост и здоровье плода на протяжении всей жизни.
Реакция плаценты на нарушения в материнском компартменте сложна и остается плохо изученной, что подчеркивает острую необходимость в дальнейших хорошо спланированных и механистических исследованиях в этой области.Стратегии вмешательства для облегчения осложнений беременности и предотвращения развития эмбрионального развития болезни у взрослых, вероятно, будут наиболее эффективными, если нацелена функция плаценты. mTOR представляет собой важный сигнальный путь восприятия питательных веществ, который, как считается, играет ключевую роль в восприятии питательных веществ в плаценте. Материнское ожирение с чрезмерным ростом плода связано с активацией плацентарной передачи сигналов mTOR и повышающей регуляцией плацентарного транспорта питательных веществ как на животных моделях (Aye et al., 2015; Rosario et al., 2015а, б) и у женщин (Jansson et al., 2013). Недавно мы сообщили, что нормализация материнских уровней адипонектина в крови у мышей с ожирением полностью предотвратила активацию плацентарной передачи сигналов mTOR, усиление плацентарного транспорта питательных веществ и избыточный рост плода (Aye et al., 2015), что согласуется с идеей, что нацеливание на плацентарный mTOR может представляют собой эффективную стратегию вмешательства в случаях аномального роста плода.
Авторские взносы
KD и TJ написали статью.ПБ и ТП редактировали газету.
Финансирование
Эта работа финансировалась грантами NIH HD078376, HD065007, HD68370, R24OD016724, HD021350 и DK089989.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Абрамс, Э. Т., Браун, Х., Ченсу, С. В., Тернер, Г. Д., Тадесс, Э., Лема, В. М. и др. (2003). Ответ хозяина на малярию во время беременности: привлечение моноцитов плаценты связано с повышенной экспрессией бета-хемокинов. J. Immunol. 170, 2759–2764. DOI: 10.4049 / jimmunol.170.5.2759
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андерсон, А. Х., Феннесси, П. В., Меския, Г., Уилкенинг, Р. Б., и Батталья, Ф. К. (1997). Плацентарный транспорт треонина и его использование у нормального плода и плода с задержкой роста. Am. J. Physiol. 272, E892 – E900.
PubMed Аннотация | Google Scholar
Армитаж, Дж. А., Хан, И. Ю., Тейлор, П. Д., Натаниэльс, П. В., и Постон, Л. (2004). Программирование развития метаболического синдрома из-за дисбаланса питания матери: насколько убедительны данные экспериментальных моделей на млекопитающих? J. Physiol. 561, 355–377. DOI: 10.1113 / jphysiol.2004.072009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Одетт, М.К., Чаллис, Дж. Р., Джонс, Р. Л., Сибли, К. П., и Мэтьюз, С. Г. (2011). Антенатальное лечение дексаметазоном в середине беременности снижает опосредованный системой А транспорт в плаценте мышей на поздних сроках беременности. Эндокринология 152, 3561–3570. DOI: 10.1210 / en.2011-0104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ай, И. Л., Гао, X., Вайнтрауб, С. Т., Янссон, Т., и Пауэлл, Т. Л. (2014a). Адипонектин подавляет функцию инсулина в первичных трофобластах за счет PPAR-опосредованного синтеза церамидов. Mol. Эндокринол. 28, 512–524. DOI: 10.1210 / me.2013-1401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Aye, I. L., Lager, S., Ramirez, V. I., Gaccioli, F., Dudley, D. J., Jansson, T., et al. (2014b). Повышение индекса массы тела матери связано с системным воспалением у матери и активацией отдельных воспалительных путей плаценты. Biol. Репродукция. 90, 129. doi: 10.1095 / биолрепрод.113.116186
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Да, И.Л. М. Х., Янссон, Т., и Пауэлл, Т. Л. (2013b). Интерлейкин-1 бета подавляет передачу сигналов инсулина и предотвращает стимулируемый инсулином транспорт аминокислот системы А в первичных трофобластах человека. Mol. Клетка. Эндокринол. 381, 46–55. DOI: 10.1016 / j.mce.2013.07.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ай, И. Л., Пауэлл, Т. Л., и Янссон, Т. (2013a). Обзор: адипонектин – недостающее звено между ожирением матери, переносом плаценты и ростом плода? Плацента 34 (Доп.), S40 – S45. DOI: 10.1016 / j.placenta.2012.11.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ай, И. Л., Розарио, Ф. Дж., Пауэлл, Т. Л., и Янссон, Т. (2015). Добавление адипонектина беременным мышам предотвращает неблагоприятное влияние материнского ожирения на функцию плаценты и рост плода. Proc. Natl. Акад. Sci. США 112, 12858–12863. DOI: 10.1073 / pnas.1515484112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баркер, Д.J., Osmond, C., Golding, J., Kuh, D., and Wadsworth, M.E. (1989). Рост матки , артериальное давление в детстве и взрослой жизни и смертность от сердечно-сосудистых заболеваний. BMJ 298, 564–567. DOI: 10.1136 / bmj.298.6673.564
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баркер Д. Дж. П. и Осмонд К. (1986). Младенческая смертность, питание детей и ишемическая болезнь сердца в Англии и Уэльсе. Ланцет 1, 1077–1081. DOI: 10.1016 / S0140-6736 (86)
-1PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауманн М. У., Шнайдер Х., Малек А., Палта В., Сурбек Д. В., Сагер Р. и др. (2014). Регулирование переносчика глюкозы GLUT1 трофобласта человека с помощью инсулиноподобного фактора роста I (IGF-I). PLoS ONE 9: e106037. DOI: 10.1371 / journal.pone.0106037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Boeuf, P., Aitken, E.H., Chandrasiri, U., Chua, C.Л., МакИнерни Б., Маккуэйд Л. и др. (2013). Plasmodium falciparum малярия вызывает воспалительные реакции, нарушающие регуляцию транспорта аминокислот через плаценту. PLoS Pathog. 9: e1003153. DOI: 10.1371 / journal.ppat.1003153
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bouyou-Akotet, M. K., Kombila, M., Kremsner, P. G., and Mavoungou, E. (2004). Профили цитокинов в периферической, плацентарной и пуповинной крови у беременных женщин из района, эндемичного для Plasmodium falciparum . Eur. Cytokine Netw. 15, 120–125.
PubMed Аннотация | Google Scholar
Brugarolas, J., Lei, K., Hurley, R.L., Manning, B.D., Reiling, J.H., Hafen, E., et al. (2004). Регуляция функции mTOR в ответ на гипоксию с помощью REDD1 и опухолевого супрессорного комплекса TSC1 / TSC2. Genes Dev. 18, 2893–2904. DOI: 10.1101 / gad.1256804
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бертон, Дж. Дж. (2010). Влияние внутриутробной среды на развитие плаценты человека. J. Reprod. Иммунол. 86, 81–82. DOI: 10.1016 / j.jri.2010.08.006
CrossRef Полный текст
Цетин И., Корбетта К., Серени Л. П., Маркони А. М., Бозцетти П., Парди Г. и др. (1990). Концентрации аминокислот в пуповине у нормальных плодов и плодов с задержкой роста, взятых в utero с помощью кордоцентеза. Am. J. Obstet. Гинеколь. 162, 253–261. DOI: 10.1016 / 0002-9378 (90)
-APubMed Аннотация | CrossRef Полный текст | Google Scholar
Challier, J.C., Basu, S., Bintein, T., Minium, J., Hotmire, K., Catalano, P.M, et al. (2008). Ожирение при беременности стимулирует накопление макрофагов и воспаление в плаценте. Плацента 29, 274–281. DOI: 10.1016 / j.placenta.2007.12.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чандрасири, У. П., Чуа, К. Л., Амберс, А. Дж., Чалулука, Э., Глейзер, Дж. Д., Роджерсон, С. Дж. И др. (2014). Понимание патогенеза задержки роста плода при плацентарной малярии: снижение экспрессии изоформы 1 переносчика глюкозы в плаценте. J. Infect. Дис . 209, 1663–1667. DOI: 10.1093 / infdis / jit803
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Ю. Ю., Росарио, Ф. Дж., Шехаб, М. А., Пауэлл, Т. Л., Гупта, М. Б., и Янссон, Т. (2015). Повышенное убиквитинирование и снижение переноса через плазматическую мембрану переносчика аминокислот из плаценты SNAT-2 в IUGR человека. Clin. Sci . 129, 1131–1141. DOI: 10.1042 / CS20150511
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дальгрен, Дж., Nilsson, C., Jennische, E., Ho, H.P., Eriksson, E., Niklasson, A., et al. (2001). Воздействие пренатальных цитокинов приводит к ожирению и гендерно-зависимым программам. Am. J. Physiol. Эндокринол. Метаб. 281, E326 – E334.
PubMed Аннотация | Google Scholar
де Бу, Х. А., Еремия, С. К., Блумфилд, Ф. Х., Оливер, М. Х., и Хардинг, Дж. Э. (2008). Лечение задержки внутриутробного развития овец с помощью гормона роста матери. Am. J. Obstet.Гинеколь. 199, e551 – e559. DOI: 10.1016 / j.ajog.2008.04.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Desai, M., ter Kuile, F.O., Nosten, F., McGready, R., Asamoa, K., Brabin, B., et al. (2007). Эпидемиология и бремя малярии у беременных. Lancet Infect. Дис. 7, 93–104. DOI: 10.1016 / S1473-3099 (07) 70021-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Desoye, G., Hartmann, M., Blaschitz, A., Dohr, G., Hahn, T., Kohnen, G., et al. (1994). Рецепторы инсулина в синцитиотрофобласте и эндотелии плода плаценты человека. Иммуногистохимические данные об изменениях в структуре распределения, связанных с развитием. Гистохимия 101, 277–285. DOI: 10.1007 / BF00315915
PubMed Аннотация | CrossRef Полный текст | Google Scholar
de Vrijer, B., Regnault, T. R., Wilkening, R. B., Meschia, G., and Battaglia, F. C. (2004). Плацентарный захват и транспорт АСР, нейтральной неметаболизируемой аминокислоты, в модели ограничения роста плода у овец. Am. J. Physiol. Эндокринол. Метаб. 287, E1114 – E1124. DOI: 10.1152 / ajpendo.00259.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диас П., Пауэлл Т. Л. и Янссон Т. (2014). Роль определения питательных веществ в плаценте в распределении ресурсов матери и плода. Biol. Репродукция. 91, 82. doi: 10.1095 / биолрепрод.114.121798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эбенбихлер, К. Ф., Касер, С., Лаймер, М., Вольф, Х. Дж., Патч, Дж. Р., Илсли, Н. П. (2002). Полярная экспрессия и фосфорилирование изоформ рецептора лептина человека в парных, синцитиальных, микроворсинчатых и базальных мембранах плаценты человека. Плацента 23, 516–521. DOI: 10.1053 / plac.2002.0836
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Экономидес Д. Л., Николаидес К. Х., Гал В. А., Бернардини И. и Эванс М. И. (1989). Аминокислоты в плазме крови плода подходящего и малого для гестационного возраста. Am. J. Obstet. Гинеколь. 161, 1219–1227. DOI: 10.1016 / 0002-9378 (89)
-4PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фанг, Дж., Фурез, Т. К., Лурент, Р. С., Смит, К. Х., и Фант, М. Е. (1997). Пространственная поляризация рецепторов инсулиноподобного фактора роста на синцитиотрофобласте человека. Pediatr. Res. 41, 258–265. DOI: 10.1203 / 00006450-199702000-00017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Форсдаль, А.(1977). Являются ли плохие условия жизни в детстве и подростковом возрасте важным фактором риска артериосклеротической болезни сердца? Br. J. Prev. Soc. Med. 31, 91–95. DOI: 10.1136 / jech.31.2.91
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фоуден, А. Л., Форхед, А. Дж., Сферруцци-Перри, А. Н., Бертон, Г. Дж., И Воган, О. Р. (2015). Обзор: эндокринная регуляция фенотипа плаценты. Плацента 36 (Дополнение 1), S50 – S59. DOI: 10.1016 / j.placenta.2014.11.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаччоли, Ф., Лагер, С., Пауэлл, Т. Л., и Янссон, Т. (2013). Плацентарный транспорт в ответ на изменение питания матери. J. Dev. Ориг. Health Dis. 4, 101–115. DOI: 10.1017 / S2040174412000529
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гангули А., Коллис Л. и Деваскар С. У. (2012). Плацентарный транспорт глюкозы и аминокислот у мышей дикого типа с ограничением калорийности и гетерозиготных по Glut3 мышей. Эндокринология 153, 3995–4007. DOI: 10.1210 / en.2011-1973
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джуссани, Д. А., Салинас, К. Э., Виллена, М., и Бланко, К. Э. (2007). Роль кислорода в пренатальном росте: исследования на курином эмбрионе. J. Physiol. 585, 911–917. DOI: 10.1113 / jphysiol.2007.141572
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стекольщик, Дж. Д., Цетин, И., Перуджино, Г., Ронзони, С., Грей А.М., Махендран Д. и др. (1997). Связь между активностью системы переносчика аминокислот в микроворсинчатой плазматической мембране плаценты человека и тяжестью нарушения плода при ограничении внутриутробного развития. Pediatr. Res. 42, 514–519. DOI: 10.1203 / 00006450-199710000-00016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Глейзер, Дж. Д., Сибли, К. П., и Картер, А. М. (1996). Влияние ограничения роста плода на активность транспортера аминокислот системы А в обращенной к матери плазматической мембране синцитиотрофобласта крысы. Pediatr. Res. 40, 325–329. DOI: 10.1203 / 00006450-199608000-00022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гайятт, Х. Л., и Сноу, Р. У. (2004). Влияние малярии во время беременности на низкий вес при рождении в странах Африки к югу от Сахары. Clin. Microbiol. Rev. 17, 760–769. DOI: 10.1128 / CMR.17.4.760-769.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейлз, К. Н., Баркер, Д. Дж. П., Кларк, П. М. С., Кокс, Л.J., Fall, C., Osmond, C., et al. (1991). Рост плода и ребенка и нарушение толерантности к глюкозе в возрасте 64 лет. Br. Med. J. 303, 1019–1022. DOI: 10.1136 / bmj.303.6809.1019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрнандес-Валенсия, М., Сарате, А., Очоа, Р., Фонсека, М. Э., Амато, Д., и Де Хесус Ортис, М. (2001). Инсулиноподобный фактор роста I, эпидермальный фактор роста и трансформирующий фактор роста бета экспрессия и их связь с задержкой внутриутробного роста плода, например, с развитием во время беременности человека. Диабет, ожирение. Метаб. 3, 457–462. DOI: 10.1046 / j.1463-1326.2001.00168.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холмс, Р., Монтемагно, Р., Джонс, Дж., Прис, М., Родек, К., и Сотхилл, П. (1997). Инсулиноподобные факторы роста и связывающие белки плазмы плода и матери при беременности с надлежащим или замедленным ростом плода. Early Hum. Dev. 49, 7–17. DOI: 10.1016 / S0378-3782 (97) 01867-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ингворсен, К., Брикс, С., Озанн, С. Э., Хеллгрен, Л. И. (2015). Влияние материнского воспаления на программирование метаболических заболеваний плода. Acta Physiol. 214, 440–449. DOI: 10.1111 / apha.12533
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ingvorsen, C., Thysen, A.H., Fernandez-Twinn, D., Nordby, P., Nielsen, K.F., Ozanne, S.E., et al. (2014). Влияние беременности на воспаление, вызванное ожирением, на мышиной модели программирования плода. Внутр. J. Obes. 38, 1282–1289. DOI: 10.1038 / ijo.2014.69
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иоаннидис, Л. Дж., Ни, К. К., и Хансен, Д. С. (2014). Роль хемокинов в тяжелой форме малярии: больше, чем кажется на первый взгляд. Паразитология 141, 602–613. DOI: 10.1017 / S0031182013001984
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Н., Гринвуд, С. Л., Йоханссон, Б. Р., Пауэлл, Т. Л., и Янссон, Т. (2003). Лептин стимулирует активность переносчика аминокислот системы А во фрагментах ворсинок плаценты человека. J. Clin. Эндокринол. Метаб. 88, 1205–1211. DOI: 10.1210 / jc.2002-021332
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Н., Нильсфельт, А., Геллерстедт, М., Веннергрен, М., Россандер-Хюлтен, Л., Пауэлл, Т. Л. и др. (2008). Материнские гормоны, связывающие индекс массы тела матери и диетическое питание с массой тела при рождении. Am. J. Clin. Nutr. 87, 1743–1749.
PubMed Аннотация | Google Scholar
Янссон, Н., Петтерссон, Дж., Haafiz, A., Ericsson, A., Palmberg, I., Tranberg, M., et al. (2006). Подавление плацентарного транспорта аминокислот предшествует развитию ограничения внутриутробного развития у крыс, получавших низкобелковую диету. J. Physiol. Лондон. 576, 935–946. DOI: 10.1113 / jphysiol.2003.550004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Н., Росарио, Ф. Дж., Гаччоли, Ф., Лагер, С., Джонс, Х. Н., Роос, С. и др. (2013). Активация плацентарной передачи сигналов mTOR и переносчиков аминокислот у тучных женщин, рожающих крупных детей. J. Clin. Эндокринол. Метаб. 98, 105–113. DOI: 10.1210 / jc.2012-2667
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Т., Ай, И. Л., и Гобердхан, Д. К. (2012). Возникающая роль передачи сигналов mTORC1 в восприятии питательных веществ плацентой. Плацента 33 (Дополнение 2), e23 – e29. DOI: 10.1016 / j.placenta.2012.05.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Т., Экстранд, Ю., Бьорн, К., Веннергрен, М.и Пауэлл Т. Л. (2002a). Изменение активности плацентарных переносчиков аминокислот при беременности, осложненной диабетом. Диабет 51, 2214–2219. DOI: 10.2337 / диабет.51.7.2214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Т., и Перссон, Э. (1990). Плацентарный перенос глюкозы и аминокислот при задержке внутриутробного развития – исследования с аналогами субстрата на бодрствующих морских свинках. Pediatr. Res. 28, 203–208.DOI: 10.1203 / 00006450-19
00-00007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Т., и Пауэлл, Т. Л. (2006). Плацентарный перенос человека при изменении роста плода: функционирует ли плацента как датчик питательных веществ? Rev. Плацента 27, S91 – S97. DOI: 10.1016 / j.placenta.2005.11.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Т., Шольтбах, В., и Пауэлл, Т. Л. (1998). Плацентарный транспорт лейцина и лизина снижается при ограничении внутриутробного развития. Pediatr. Res. 44, 532–537. DOI: 10.1203 / 00006450-199810000-00011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Т., Веннергрен, М., Илсли, Н. П. (1993). Экспрессия белка-переносчика глюкозы в плаценте человека на протяжении всей беременности и при задержке внутриутробного развития. J. Clin. Эндокринол. Метаб. 77, 1554–1562.
PubMed Аннотация | Google Scholar
Янссон, Т., Веннергрен, М., и Пауэлл, Т.Л. (1999). Плацентарный транспорт глюкозы и экспрессия GLUT 1 при инсулинозависимом диабете. Am. J. Obstet. Гинеколь. 180, 163–168. DOI: 10.1016 / S0002-9378 (99) 70169-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янссон, Т., Илвен, К., Веннергрен, М., и Пауэлл, Т. Л. (2002b). Транспорт глюкозы и активность системы А в микроворсинках и базальных плазматических мембранах синцитиотрофобластов при ограничении внутриутробного роста. Плацента 23, 392–399.DOI: 10.1053 / plac.2002.0826
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jiang, H., Xun, P. C., Luo, G.H., Wang, Q. W., Cai, Y. Q., Zhang, Y. Y., et al. (2009). Уровни инсулиноподобных факторов роста и их рецепторов в плаценте в отношении макросомии. Asia Pac. J. Clin. Nutr. 18, 171–178.
PubMed Аннотация | Google Scholar
Джонс, Х. Н., Кромблхолм, Т., и Хабли, М. (2013). Опосредованный аденовирусами перенос плацентарного гена IGF-1 корректирует плацентарную недостаточность за счет усиления механизмов плацентарного транспорта глюкозы. PLoS ONE 8: e74632. DOI: 10.1371 / journal.pone.0074632
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Х. Н., Янссон, Т., и Пауэлл, Т. Л. (2009a). IL-6 стимулирует активность переносчика аминокислот системы А в клетках трофобласта посредством STAT3 и повышенной экспрессии SNAT2. Am. J. Physiol. Cell Physiol. 297, C1228 – C1235. DOI: 10.1152 / ajpcell.00195.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Х.Н., Янссон, Т., и Пауэлл, Т. Л. (2010). Полноразмерный адипонектин ослабляет передачу сигналов инсулина и ингибирует стимулируемый инсулином транспорт аминокислот в первичных клетках трофобласта человека. Диабет 59, 1161–1170. DOI: 10.2337 / db09-0824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Х. Н., Вуллет, Л. А., Барбур, Н., Прасад, П. Д., Пауэлл, Т. Л., и Янссон, Т. (2009b). Диета с высоким содержанием жиров до и во время беременности вызывает заметное усиление регуляции транспорта питательных веществ через плаценту и разрастание плода у мышей C57 / BL6. FASEB J. 23, 271–278. DOI: 10.1096 / fj.08-116889
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кабиемела, Э. Р., Муленбах, А., Фрид, М., Куртис, Дж. Д., Мутабингва, Т. К., и Даффи, П. Э. (2008). Уровень IL-10 в периферической крови матери как маркер воспалительной плацентарной малярии. Малар. J. 7:26. DOI: 10.1186 / 1475-2875-7-26
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карл П. И. (1995).Инсулиноподобный фактор роста-1 стимулирует поглощение аминокислот культивированным плацентарным трофобластом человека. J. Cell. Physiol. 165, 83–88. DOI: 10.1002 / jcp.1041650111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карл П. И., Альпи К. Л. и Фишер С. Е. (1992). Транспорт аминокислот культивированным трофобластом плаценты человека: влияние инсулина на транспорт AIB. Am. J. Physiol. 262, C834 – C839.
PubMed Аннотация | Google Scholar
Кавита, Дж.В., Росарио, Ф. Дж., Ниджланд, М. Дж., Макдональд, Т. Дж., Ву, Г., Канаи, Ю. и др. (2014). Подавление плацентарного mTOR, передачи сигналов инсулина / IGF-I и переносчиков питательных веществ в ответ на ограничение питательных веществ у бабуина со стороны матери. FASEB J. 28, 1294–1305. DOI: 10.1096 / fj.13-242271
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кесвани С.Г., Баладжи С., Кац А.Б., Кинг А., Омар К., Хабли М. и др. (2015). Внутриплацентарная генная терапия Ad-IGF-1 корректирует естественную кроличью модель ограничения внутриутробного роста. Hum. Gene Ther. 26, 172–182. DOI: 10.1089 / hum.2014.065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лаушус Ф. Ф., Клебе Дж. Г. и Фливбьерг А. (2001). Макросомия, связанная с инсулиноподобным фактором роста-I и -II в материнской сыворотке при диабетической беременности. Акушерство. Гинеколь. 97, 734–741. DOI: 10.1016 / S0029-7844 (01) 01189-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лавиола, Л., Перрини, С., Белсанти, Г., Наталиккио А., Монтроне К., Леонардини А. и др. (2005). Ограничение внутриутробного развития у людей связано с нарушениями передачи сигналов инсулиноподобного фактора роста через плаценту. Эндокринология 146, 1498–1505. DOI: 10.1210 / en.2004-1332
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Л., Хардинг Дж. Э., Эванс П. К. и Глюкман П. Д. (1994). Инфузия материнского инсулиноподобного фактора роста I изменяет фетоплацентарный углеводный и белковый обмен у беременных овец. Эндокринология 135, 895–900.
PubMed Аннотация | Google Scholar
Магнуссон, А. Л., Уотерман, И. Дж., Веннергрен, М., Янссон, Т., и Пауэлл, Т. Л. (2004). Активность триглицеридгидролазы и экспрессия белков, связывающих жирные кислоты, в плаценте человека при беременности, осложненной задержкой внутриутробного развития и диабетом. J. Clin. Эндокринол. Метаб. 89, 4607–4614. DOI: 10.1210 / jc.2003-032234
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махендран, Д., Donnai, P., Glazier, J. D., D’souza, S. W., Boyd, R. D., and Sibley, C. P. (1993). Активность переносчика аминокислот (система А) в микроворсинчатых мембранных пузырьках из плаценты подходящих и малых для гестационного возраста детей. Pediatr. Res. 34, 661–665. DOI: 10.1203 / 00006450-199311000-00019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маландро М. С., Беверидж М. Дж., Килберг М. С. и Новак Д. А. (1996). Влияние задержки внутриутробного развития плода, вызванной низкобелковой диетой, на транспорт аминокислот через плаценту крысы. Am. J. Physiol. 271, C295 – C303.
PubMed Аннотация | Google Scholar
Мехта А. Р. и Мехта П. Р. (2008). Гипоксия на большой высоте вызывает ограничение роста плода у куриных эмбрионов, степень этого эффекта зависит от высотного статуса матери. J. Physiol. 586, 1469–1471. DOI: 10.1113 / jphysiol.2008.151332
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нельсон, Д. М., Смит, С. Д., Фурез, Т. К., Садовский Ю., Ганапати В., Парвин К. А. и др. (2003). Гипоксия снижает экспрессию и функцию транспортеров аминокислот системы А в культивируемых термических трофобластах человека. Am. J. Physiol. Cell Physiol. 284, C310 – C315. DOI: 10.1152 / ajpcell.00253.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нильссон, К., Ларссон, Б. М., Дженнише, Э., Эрикссон, Э., Бьорнторп, П., Йорк, Д. А., и др. (2001). Материнская эндотоксемия приводит к ожирению и инсулинорезистентности у взрослых потомков мужского пола. Эндокринология 142, 2622–2630. DOI: 10.1210 / en.142.6.2622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ницан, М., Орлофф, С., и Шульман, Дж. Д. (1979). Плацентарный перенос аналогов глюкозы и аминокислот при экспериментальной задержке внутриутробного развития плода. Pediatr. Res. 13, 100–103. DOI: 10.1203 / 00006450-197
0-00003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Норберг, С., Пауэлл, Т. Л.и Янссон Т. (1998). Ограничение внутриутробного развития связано со снижением активности плацентарных транспортеров таурина. Pediatr. Res. 44, 233–238. DOI: 10.1203 / 00006450-199808000-00016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Орди, Дж., Исмаил, М. Р., Вентура, П. Дж., Кахигва, Э., Хирт, Р., Кардеса, А. и др. (1998). Массивный хронический интервиллозит плаценты, связанный с малярийной инфекцией. Am. J. Surg. Патол. 22, 1006–1011.DOI: 10.1097 / 00000478-199808000-00011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Падоан А., Ригано С., Феррацци Э., Бити Б. Л., Батталья Ф. К. и Галан Х. Л. (2004). Различия в пропорциях жировой и мышечной массы у нормальных плодов и плодов с задержкой роста. Am. J. Obstet. Гинеколь. 191, 1459–1464. DOI: 10.1016 / j.ajog.2004.06.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pantham, P., Rosario, F. J., Njiland, M., Cheung, A., Nathanielsz, P. W., Powell, T. L., et al. (2015b). Снижение транспорта аминокислот через плаценту в ответ на ограничение питательных веществ у бабуина. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 309, R740 – R746. DOI: 10.1152 / ajpregu.00161.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паолини, К. Л., Маркони, А. М., Ронзони, С., Ди Нойо, М., Феннесси, П. В., Парди, Г. и др. (2001). Плацентарный транспорт лейцина, фенилаланина, глицина и пролина при беременностях с задержкой внутриутробного развития. J. Clin. Эндокринол. Метаб. 86, 5427–5432. DOI: 10.1210 / jcem.86.11.8036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ravelli, A.C.J., van der Meulen, J.H.P., Michels, R.P.J., Osmond, C., Barker, D.J.P., Hales, C.N., et al. (1998). Толерантность к глюкозе у взрослых после дородового воздействия голода. Ланцет 351, 173–177. DOI: 10.1016 / S0140-6736 (97) 07244-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рид, Г.Дж., Лейн, Р. Х., Флозак, А. С., и Симмонс, Р. А. (1999). Плацентарная экспрессия белков-переносчиков глюкозы 1 и 3 у плодных крыс с ограниченным ростом. Am. J. Obstet. Гинеколь. 180, 1017–1023. DOI: 10.1016 / S0002-9378 (99) 70675-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роджерсон С.Дж., Браун Х.С., Поллина Э., Абрамс Э. Т., Тадесс Э., Лема В. М. и др. (2003). Фактор некроза плацентарной опухоли альфа, но не гамма-интерферон, связан с плацентарной малярией и низкой массой тела при рождении у малавийских женщин. Заражение. Иммун. 71, 267–270. DOI: 10.1128 / IAI.71.1.267-270.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роджерсон, С. Дж., Хвиид, Л., Даффи, П. Э., Леке, Р. Ф., и Тейлор, Д. У. (2007). Малярия при беременности: патогенез и иммунитет. Lancet Infect. Дис. 7, 105–117. DOI: 10.1016 / S1473-3099 (07) 70022-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роос, С., Янссон, Н., Палмберг, И., Сальё, К., Пауэлл, Т. Л., и Янссон, Т. (2007). Мишень рапамицина млекопитающих в плаценте человека регулирует транспорт лейцина и подавляется при ограниченном росте плода. J. Physiol. 582, 449–459. DOI: 10.1113 / jphysiol.2007.129676
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роос, С., Канаи, Ю., Прасад, П. Д., Пауэлл, Т. Л., и Янссон, Т. (2009). Регулирование активности плацентарного переносчика аминокислот с помощью рапамицина-мишени млекопитающих. Am.J. Physiol. Cell Physiol. 296, C142 – C150. DOI: 10.1152 / ajpcell.00330.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росарио, Ф. Дж., Димасуай, К. Г., Канаи, Ю., Пауэлл, Т. Л., и Янссон, Т. (2015a). Регулирование транспорта переносчиков аминокислот с помощью mTORC1 в первичных клетках трофобласта человека опосредуется убиквитинлигазой Nedd4-2. Clin Sci (Лондон). DOI: 10.1042 / CS20150554. [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росарио, Ф.Дж., Янссон, Н., Канаи, Ю., Прасад, П. Д., Пауэлл, Т. Л., и Янссон, Т. (2011). Ограничение материнского белка у крыс подавляет передачу сигналов плацентарного инсулина, mTOR и STAT3 и подавляет плацентарные переносчики аминокислот. Эндокринология 152, 1119–1129. DOI: 10.1210 / en.2010-1153
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росарио, Ф. Дж., Канаи, Ю., Пауэлл, Т. Л., и Янссон, Т. (2013). Мишень млекопитающих для передачи сигналов рапамицина модулирует поглощение аминокислот, регулируя изобилие на поверхности клеток-переносчиков в первичных клетках трофобласта человека. J. Physiol. 591, 609–625. DOI: 10.1113 / jphysiol.2012.238014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росарио, Ф. Дж., Канаи, Ю., Пауэлл, Т. Л., и Янссон, Т. (2015b). Повышенный перенос питательных веществ через плаценту в новой модели материнского ожирения с избыточным ростом плода на мышах. Ожирение 23, 1663–1670. DOI: 10.1002 / oby.21165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росарио, Ф. Дж., Шумахер, М.А., Цзян, Дж., Канаи, Ю., Пауэлл, Т. Л., и Янссон, Т. (2012). Хроническая инфузия материнской адипонектина полной длины беременным мышам подавляет активность и экспрессию плацентарного переносчика аминокислот и снижает рост плода. J. Physiol. (Лондон). 590, 1495–1509. DOI: 10.1113 / jphysiol.2011.226399
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росс, Дж. К., Феннесси, П. В., Уилкенинг, Р. Б., Батталья, Ф. К., и Меския, Г. (1996). Плацентарный транспорт и использование плода лейцина в модели задержки роста плода. Am. J. Physiol. 270, E491 – E503.
PubMed Аннотация | Google Scholar
Россо П. (1977a). Обмен матери и плода при белковом недоедании у крыс. Плацентарный перенос альфа-амино изомасляной кислоты. J. Nutr. 107, 2002–2005.
PubMed Аннотация | Google Scholar
Россо П. (1977b). Обмен матери и плода при белковом недоедании у крыс. Плацентарный перенос глюкозы и неметаболизируемого аналога глюкозы. Дж.Nutr. 107, 20006–20010.
PubMed Аннотация | Google Scholar
Сферруцци-Перри, А. Н., Оуэнс, Дж. А., Прингл, К. Г., и Робертс, К. Т. (2011a). Пренебрежение ролью инсулиноподобных факторов роста в материнском кровообращении, регулирующих рост плода. J. Physiol. (Лондон). 589, 7–20. DOI: 10.1113 / jphysiol.2010.198622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сферруцци-Перри, А. Н., Воган, О. Р., Коан, П. М., Сучиу, М.C., Darbyshire, R., Constancia, M., et al. (2011b). Плацентарный дефицит Igf2 изменяет адаптацию развития мышей к недоеданию. Эндокринология 152, 3202–3212. DOI: 10.1210 / en.2011-0240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Steketee, R. W., Nahlen, B. L., Parise, M. E., and Menendez, C. (2001). Бремя малярии во время беременности в эндемичных по малярии районах. Am. J. Trop. Med. Hyg. 64, 28–35.
PubMed Аннотация | Google Scholar
Сугитан, А.Л. мл., Леке, Р. Г., Фуда, Г., Чжоу, А., Туита, Л., Метену, С. и др. (2003). Изменения уровней хемокинов и цитокинов в плаценте у женщин с малярией Plasmodium falciparum . J. Infect. Дис. 188, 1074–1082. DOI: 10.1086 / 378500
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тонгсонг Б., Субраманиан Р. К., Ганапати В. и Прасад П. Д. (2005). Ингибирование системы транспорта аминокислот а интерлейкином-1 бета в трофобластах. J. Soc. Гинеколь. Расследование. 12, 495–503. DOI: 10.1016 / j.jsgi.2005.06.008
CrossRef Полный текст | Google Scholar
Турин, П. Дж., Тремблер, К. А., Меския, Г., Маковски, Е. Л., и Вилкенинг, Р. Б. (1992). Плацентарный транспорт глюкозы при задержке роста плода, вызванной течкой. Am. J. Physiol. 263, R578 – R585.
PubMed Аннотация | Google Scholar
Амберс, А. Дж., Бёф, П., Клэпхэм, К., Станишич, Д. И., Байвог, Ф., Мюллер, И., и другие. (2011). Воспаление, связанное с плацентарной малярией, нарушает инсулиноподобный фактор роста, регулирующий рост плода. J. Infect. Дис. 203, 561–569. DOI: 10.1093 / infdis / jiq080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Воан, О. Р., Сферруцци-Перри, А. Н., и Фоуден, А. Л. (2012). Материнский кортикостерон регулирует выделение питательных веществ для роста плода у мышей. J. Physiol. (Лондон). 590, 5529–5540. DOI: 10.1113 / jphysiol.2012.239426
PubMed Аннотация | CrossRef Полный текст | Google Scholar
фон Версен-Хёйнк, Ф., Раджакумар, А., Паррот, М. С., и Пауэрс, Р. В. (2009). Лептин влияет на транспортную активность аминокислот системы А в плаценте человека: данные о механизмах, зависимых от STAT3. Плацента 30, 361–367. DOI: 10.1016 / j.placenta.2009.01.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wadsack, C., Tabano, S., Maier, A., Hiden, U., Alvino, G., Cozzi, V., et al. (2007). Ограничение внутриутробного развития связано с изменениями рецепторов липопротеинов плаценты и липопротеидного состава матери. Am. J. Physiol. Эндокринол. Метаб. 292, E476 – E484. DOI: 10.1152 / ajpendo.00547.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йылдыз, Л., Авчи, Б., и Ингеч, М. (2002). Концентрация лептина в пуповине и материнской крови при задержке внутриутробного развития. Clin. Chem. Лаборатория.Med. 40, 1114–1117. DOI: 10.1515 / cclm.2002.195
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yung, H. W., Calabrese, S., Hynx, D., Hemmings, B.A., Cetin, I., Charnock-Jones, D. S., et al. (2008). Доказательства ингибирования трансляции плаценты и стресса эндоплазматического ретикулума в этиологии ограничения внутриутробного развития человека. Am. J. Pathol. 173, 451–462. DOI: 10.2353 / ajpath.2008.071193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Замудио, С., Бауман, М. У., Илсли, Н. П. (2006). Влияние хронической гипоксии in vivo на экспрессию плацентарных переносчиков глюкозы человека. Плацента 27, 49–55. DOI: 10.1016 / j.placenta.2004.12.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Замудио, С., Мур, Л. Г. (2000). Высота и рост плода: текущие знания и направления на будущее. Ультразвуковой акушер. Гинеколь. 16, 6–8. DOI: 10.1046 / j.1469-0705.2000.00155.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Недостаточность плаценты
Плацента – это животворный орган, который формируется в утробе матери, когда она беременеет.Плацента прикрепляется к пуповине и играет решающую роль в росте и развитии плода.
Плацентарная недостаточность (или «плацентарная дисфункция», «маточно-плацентарная недостаточность» или фетоплацентарная недостаточность) – серьезное нарушение, которое может возникнуть во время беременности, когда плацента не формируется должным образом или повреждается. Это может привести к тому, что плацента не сможет доставлять плоду достаточное количество питательных веществ и кислорода. Хроническая плацентарная недостаточность также может привести к снижению доставки калорий к плоду с задержкой внутриутробного развития.
Функции плаценты во время беременности Плацента – уникальный и сложный продукт репродуктивной биологии человека. Плацента образуется и начинает быстро расти внутри матки, когда оплодотворенная яйцеклетка прикрепляется к стенке матки. Важность работы, которую выполняет плацента, невозможно переоценить.
Жизненно важная пуповина формируется, вырастает из плаценты и прикрепляется к плоду. Пуповина и плацента работают вместе, обеспечивая циркуляцию крови между матерью и ребенком.Плацента действует как система фильтрации и обмена питательных веществ.
Кровь матери течет в плаценту и откладывает питательные вещества и кислород. Кровь ребенка циркулирует в плаценте, собирает кислород и питательные вещества от матери и отправляет их ребенку. Плацента выполняет несколько важных функций в этом процессе, включая
- Вливание кислорода в кровоток ребенка
- Удаление углекислого газа из системы ребенка
- Доставка питательных веществ ребенку
- Извлечение отходов от ребенка к матери
Плацента также участвует в производстве определенных гормонов беременности и в защите ребенка от инфекции.Плацента растет впереди плода и продолжает расти на протяжении всей беременности. К моменту рождения ребенка средняя плацента весит около 1-2 фунтов. При нормальных родах плацента выходит вскоре после рождения ребенка.
Причины плацентарной недостаточности Плацентарная недостаточность вызвана более низким, чем обычно, кровотоком матери. Для правильного выполнения своих функций кровь матери должна циркулировать в плаценту на нормальном уровне. Недостаточность возникает при снижении уровня поступающего материнского кровотока.Это снижение кровотока у матери может быть вызвано несколькими заболеваниями или событиями.
Наиболее частые состояния, которые, как известно, вызывают плацентарную недостаточность, включают:
- Состояние материнской крови (гипертония) или сердечно-сосудистые заболевания
- Материнский диабет
- Анемия
- Прием препаратов, разжижающих кровь во время беременности
- Курение или употребление кокаина или амфетамины
Плацентарная недостаточность также может быть вызвана механическими осложнениями, такими как неправильное прикрепление плаценты к матке или ее внезапное отслоение (отслойка плаценты).
Симптомы недостаточности плаценты
Вы редко видите очевидные материнские симптомы недостаточности плаценты. Большинство мам с плацентарной недостаточностью ничего не чувствуют. Подсказки о том, что что-то не так, как правило, очень тонкие. Например, во время второй беременности мать может заметить, что ее животик не становится таким большим или полным, как у ее предыдущего ребенка. Младенцы, страдающие плацентарной недостаточностью, также гораздо меньше двигаются в утробе матери.
Диагностика плацентарной недостаточности
Как правило, чем раньше диагностируются признаки недостаточности плаценты, тем выше вероятность благоприятного исхода для плода. Ключом к быстрой и ранней диагностике недостаточности плаценты является качественная дородовая помощь. Достижение окончательного диагноза маточно-плацентарной недостаточности обычно является результатом различных пренатальных диагностических инструментов, включая:
- Ультразвуковая визуализация дает врачам картину плаценты и позволяет им сформулировать приблизительные измерения плаценты.
- Ультразвуковые изображения для измерения размера плаценты. плод
- Анализ крови для проверки нормального или аномального уровня определенного белка, вырабатываемого печенью ребенка, который называется альфа-фетопротеином
- Стресс-тест плода – это обычно выполняется с помощью полосок для пренатального мониторинга плода, которые будят ребенка и измеряют частоту сердечных сокращений плода и другие индикаторы дистресса
К сожалению, никакое лечение не может эффективно исправить плацентарную недостаточность.Тем не менее, тщательное лечение может успешно минимизировать возможные последствия и побочные эффекты состояния. Надлежащее ведение плацентарной недостаточности часто зависит от того, как далеко продвинулась беременность, и от стадии развития плода.
Когда дисфункция плаценты впервые проявляется на последних сроках беременности (после 35 недели), плановое кесарево сечение часто оказывается лучшим курсом действий. В большинстве случаев плацентарная недостаточность развивается намного раньше во время беременности.Успешное ведение этих случаев с ранним началом во многом зависит от ранней диагностики. После постановки диагноза плацентарной недостаточности планы лечения обычно включают следующие меры:
Есть много историй успеха в отношении плацентарной недостаточности, когда женщины получали постельный режим, часто в условиях больницы с частым наблюдением.
В дополнение к этим лечебным мерам врачи обычно назначают курс стероидов. Стероиды помогают ускорить окончательное развитие легких ребенка, что является одним из последних факторов, которые развиваются перед рождением.Это в основном мера предосторожности, предназначенная для того, чтобы ребенок мог нормально функционировать, если возникнет необходимость в ранних родах.
Восприятие матерью сниженных шевелений плода связано с изменением структуры и функции плаценты
Аннотация
Фон
Восприятие материнской ограниченности движений плода (RFM) связано с повышенным риском мертворождения и задержки роста плода (FGR). Считается, что DFM представляет собой компенсацию плода для сохранения энергии из-за недостаточного переноса кислорода и питательных веществ в результате плацентарной недостаточности.На сегодняшний день исследований структуры плаценты при ДФМ не проводилось.
Цель
Чтобы определить, связано ли восприятие матерью сокращенных движений плода (RFM) с аномалиями структуры и функции плаценты.
Дизайн
Плаценты собирали у женщин с RFM после 28 недель беременности, если роды происходили в течение 1 недели. Контрольной группой служили женщины с нормальными движениями. Плаценты взвешивали и фотографировали.Микроскопическую структуру оценивали иммуногистохимическим окрашиванием и анализом изображений. Система. Активность переносчика аминокислот измеряли как маркер функции плаценты.
Плаценты от всех беременностей с RFM (независимо от исхода) имели большую площадь с признаками инфаркта (3,5% против 0,6%; p <0,01), более высокую плотность синцитиальных узлов (p <0,001) и больший индекс пролиферации (p < 0,01). Васкулярность ворсинок (p <0,001), площадь трофобласта (p <0,01) и активность системы А (p <0.01) были снижены в плаценте от RFM по сравнению с контролем независимо от исхода беременности.
Выводы
Это исследование предоставляет доказательства аномальной морфологии и функции плаценты у женщин с RFM и поддерживает предположение о причинной связи между плацентарной недостаточностью и RFM. Это говорит о том, что женщинам с RFM требуется дальнейшее обследование для выявления женщин с плацентарной недостаточностью.
Образец цитирования: Warrander LK, Batra G, Bernatavicius G, Greenwood SL, Dutton P, Jones RL, et al.(2012) Восприятие матерью сниженных движений плода связано с изменением структуры и функции плаценты. PLoS ONE 7 (4): e34851. https://doi.org/10.1371/journal.pone.0034851
Редактор: Мартин Герберт Фраш, Монреальский университет, Канада
Поступила: 8 ноября 2011 г .; Одобрена: 9 марта 2012 г .; Опубликовано: 16 апреля 2012 г.
Авторские права: © 2012 Warrander et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Это исследование финансировалось Фондом клинических исследований Manchester Wellcome Trust и Сетью клинических исследований Большого Манчестера. Он был поддержан Национальным институтом медицинских исследований Манчестерского центра биомедицинских исследований и благотворительным фондом Action Research. LW получил стипендию от Фонда Вольфсона. AH финансируется за счет клинических лекций Национального института исследований в области здравоохранения. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
За последние 20 лет уровень мертворождения в странах с высоким уровнем дохода снизился незначительно, при этом частота мертворождений в Великобритании и США составляет примерно 5–6 случаев на 1000 живорождений [1], [2] . Частично это является следствием отсутствия достаточно чувствительных и специфических методов выявления женщин с повышенным риском мертворождения [3]. Одним из клинических признаков мертворождения является уменьшение движений плода, воспринимаемых матерью.Большинству мертворождений предшествует период снижения шевеления плода (RFM) в течение 3-4 дней, а частота мертворождений увеличивается у женщин после RFM [4], [5], [6], [7]. Однако использование RFM в качестве инструмента скрининга для выявления женщин с повышенным риском мертворождения вызывает споры; Отчасти это связано с отсутствием патофизиологических доказательств связи RFM с мертворождением.
С RFM связаны как патологические, так и непатологические состояния [8]; наиболее частая патологическая ассоциация с RFM мала для гестационного возраста (SGA) или задержки роста плода (FGR), которая затрагивает примерно 20% беременностей с RFM [9], [10], [11].Предполагается, что связь между RFM, SGA / FGR и мертворождением связана с плацентарной недостаточностью, когда нарушение функции плаценты приводит к недостатку кислорода и питательных веществ, что приводит к компенсации плода и нарушению роста плода. Продолжающаяся плацентарная недостаточность приводит к RFM и, в конечном итоге, к декомпенсации и смерти плода [12]. Эта гипотеза подтверждается наблюдениями относительной гипоксемии и ацидемии у плодов после RFM по сравнению с нормальными движениями [13].
При FGR / SGA плацента проявляет особенности аномальной структуры ворсинок, пониженной васкуляризации [14], [15], аберрантного клеточного обмена [16], [17], [18], [19], а также пониженной способности к обмен питательных веществ [20], [21].Подобных исследований, посвященных этим показателям обновления и функции плацентарных клеток в случае мертворождения, нет, при мертворождении с хронической сосудистой недостаточностью плода наблюдается снижение васкуляризации ворсинок [22]. Однако до настоящего времени не проводилось исследований, посвященных выявлению признаков аномальной структуры или функции плаценты при RFM. Целью этого исследования было проверить гипотезу о том, что плаценты от женщин, которые обратились с RFM за неделю до родов, будут иметь плаценты с аномальной морфологией и функцией.
Методы
Сбор плаценты и обработка тканей
Этическое одобрение было получено от комитетов по этике исследований Oldham и North West (ссылки 08 / h2011 / 83 и 08 / h2010 / 55), и все участники предоставили письменное информированное согласие.
Ткань, классифицированная как нормальная, была собрана у женщин с неосложненной беременностью, родивших в срок, без RFM в анамнезе (n = 36). Все женщины в больнице Святой Марии получают стандартную информацию, в которой рекомендуется обратиться в службу родовспоможения, если они заметят уменьшение подвижности своих детей.С августа 2009 г. по октябрь 2010 г. женщины, поступившие с RFM после 28 недель беременности, были набраны из отделения по беременности и родам (n = 305). RFM определяли как субъективное восприятие RFM матерью в течение как минимум 12 часов [23]. Женщины исключались из исследования при наличии аномалии плода, многоплодной беременности или аномальной частоты сердечных сокращений плода при кардиотокографии. Если участники с RFM родили в течение 7 дней после презентации (n = 36), их плаценту собирали. Этот семидневный порог был получен эмпирически, чтобы учесть временную связь между RFM и патологией плаценты.У всех набранных женщин был зарегистрирован исход беременности. Плохой исход беременности определялся как мертворождение, преждевременные роды, малый для гестационного возраста ребенок, определяемый как индивидуальный центиль с массой тела при рождении <10 th , или своевременная госпитализация в отделение интенсивной терапии новорожденных. Все они были выбраны как мертворожденные младенцы после RFM, все из которых были SGA [24], и младенцы с тяжелым внутриутробным нарушением могут не умереть, а вместо этого родиться преждевременно или потребовать неонатальной интенсивной терапии [25].
Было собраноплаценты от RFM и нормальных беременностей в течение 30 минут после рождения. Плаценты из обеих групп были собраны в течение одного и того же периода времени, и использовалась идентичная стратегия отбора проб. Были сделаны фотографии материнской и фетальной сторон плаценты, и плацента была взвешена до и после удаления оболочек и пуповины. Биопсии ворсинчатой ткани (приблизительно 1 см 3 ) иссекали от центра и края плаценты и точки посередине между ними.Ткань фиксировали в 4% нейтральном забуференном формалине в течение 24 часов и заливали воском. Для анализа активности аминокислотной транспортной системы системы А были случайным образом взяты три образца ворсинчатой ткани размером 1 см 3 и помещены в модифицированную по Дульбекко среду Игла (DMEM): контрольный буфер Тирода [135,0 мМ / л NaCl, 5,0 мМ / л KCl, 1,8 мМ / л безводный CaCl 2 , 1,0 мМ / л MgCl 2 гексагидрат, 10,0 мМ / л HEPES, 5,6 мМ / л D-глюкоза (pH 7,4)] для немедленного анализа. Если не указано иное, реагенты были приобретены у Sigma-Aldrich (Пул, Великобритания).
Иммуногистохимия
Оборот, структуру и сосудистость плацентарных клеток оценивали с использованием антител, специфичных для Ki67 (Dako, Ely, Кембриджшир, Великобритания; 0,16 мкг / мл), цитокератина-M30 (Roche, Лондон, Великобритания; 0,66 мкг / мл), цитокератина 7 (Dako ; 0,9 мкг / мл) и CD31 (Dako; 0,16 мкг / мл). Отрицательный контроль выполняли с использованием неиммунного мышиного IgG (Dako) в концентрациях, соответствующих первичному антителу.
Слайды депарафинизировали и извлечение антигена проводили путем обработки срезов в микроволновой печи в течение 10 минут при 0.01 М цитрат натрия буфер. Эндогенная пероксидаза была подавлена 3% H 2 O 2 перед неиммунным блоком (NIB, 10% козья сыворотка, 2% человеческая сыворотка, 0,1% TBS-Tween (Biorad Laboratories Ltd, Хемел Хемпстед, Хартфордшир, Великобритания). ) наносили на 30 минут. Первичные антитела / отрицательный контроль, разведенные в NIB, инкубировали в течение ночи при 4 ° C. Затем срезы подвергали воздействию биотинилированного козьего антимышиного IgG (4 мкг / мл) в течение 30 минут, а затем – авидинпероксидазы. (5 мкг / мл) в течение 30 минут.Положительное связывание антител выявляли при применении 3,3′-диаминобензидина. Слайды контрастировали, обезвоживали и очищали перед нанесением покровных стекол DPX (Raymond Lamb, Лондон, Великобритания).
Окрашивание гематоксилином и эозином было выполнено для количественной оценки синцитиальных узлов. Депарафинированные и регидратированные срезы окрашивали гематоксилином Харриса в течение 10 минут перед дифференцировкой в кислотно-спиртовой среде. Слайды окрашивали эозином в течение 2 минут, промывали холодной водопроводной водой, обезвоживали и монтировали, как описано выше.
Изображения были получены с использованием светового микроскопа Olympus BX41 (Саутенд-он-Си, Великобритания) и QIcam Fast 1394 (QImaging, Британская Колумбия, Канада) и Image Pro Plus 6.0 (Media Cybernetics Inc, Мэриленд, США). Для каждого среза было сделано 10 случайных изображений терминальных ворсинок, что дало в общей сложности 30 изображений на плаценту для каждого оцениваемого компонента.
Оценка структуры плаценты
Макроскопическую структуру плаценты оценивали с помощью программного обеспечения Image ProPlus 6.0. Площадь поверхности, максимальный, минимальный и средний диаметр, а также процент плаценты с аномально бледным внешним видом измеряли по фотографиям с помощью инструмента «интересующая область»; Было также подтверждено, что они были бледными на срезанных поверхностях плаценты.Была рассчитана мера округлости плаценты, и с помощью анализа фотографий были определены места прикрепления пуповины, которые классифицировались с использованием установленной системы следующим образом: центральная, эксцентрическая, краевая или гладкая [26].
Микроскопическую структуру оценивали следующим образом: подсчитывали количество синцитиальных узлов и измеряли общую площадь ворсинок с использованием программного обеспечения для анализа изображений (Image ProPlus 6.0), выражали как количество синцитиальных узлов на мм 2 ворсинчатой ткани, как описано ранее [19 ].Индекс пролиферации представлял собой количество Ki67-положительных ядер в процентах от общего числа ядер, как описано ранее [27]. Апоптоз оценивали по количеству ядер, окруженных цитоплазматическим окрашиванием M30, как долю от общего числа ядер на изображении. Васкуляризация выражалась как количество капилляров на терминальную ворсинку. Площадь трофобласта выражали как долю площади ворсинок, положительных по иммуноокрашиванию CK-7.
В дополнение к количественному анализу ткань плаценты, окрашенная гематоксилином и эозином, была оценена перинатальным гистопатологом (GB), который не знал исхода беременности.Для каждой плаценты были проанализированы три образца и качественно оценены на наличие инфаркта, чрезмерных синцитиальных узлов, дистальной гипоплазии ворсинок, незрелости ворсинок, виллита и других побочных аномалий.
Плацентарная система А активность поглощения
Фрагменты ворсинок плаценты (∼3–4 мм 3 ) инкубировали в растворе радиоактивно меченой N-метилированной аминоизомасляной кислоты ( 14 C-MeAIB) (0,5 мкКи / мл; 8,5 мкМ) (Perkin-Elmer, Cambridge , Кембриджшир) либо с контрольным Тиродом, либо с Na + -свободным Тиродом [NaCl заменен на 135.0 мМ / л холина хлорида] буфера в течение 30, 60 или 90 минут при 37 ° C, как описано ранее [28]. После инкубации эксплантаты лизировали в dH 2 0 в течение 16–18 часов при комнатной температуре. Радиоактивное содержание воды измеряли с помощью β-сцинтилляционного счетчика. Содержание белка в каждом ворсинчатом фрагменте определяли, помещая ткань в 0,3 М NaOH минимум на 6 часов при 37 ° C, затем используя анализ белка Bio-Rad (Bio-Rad Laboratories Ltd). Подсчет радиоактивных веществ был скорректирован на содержание белка.Поскольку система A является Na + -зависимой, ее активность рассчитывали путем вычитания поглощения Тирода, не содержащего Na + , из контроля Тирода, содержащего Na + .
Статистический анализ
Расчет мощностибыл выполнен с использованием функции PS Power and Sample Size Calculation (версия 3.0, январь 2009 г.). Расчеты мощности основывались на наших предыдущих данных по плотности синцитиальных узлов [19] и апоптозу [29], поскольку данные по другим показателям отсутствовали. Для мощности 90% и значения альфа 0.05, потребуется 6 экспериментальных образцов, чтобы показать значительную разницу в количестве синцитиальных узлов, и 12 экспериментальных образцов, которые потребуются, чтобы показать значительную разницу в апоптозе между контрольными беременностями и RFM, заканчивающимися неблагоприятным исходом беременности. Поскольку мы ожидали, что от 25 до 33% наших образцов плаценты будут иметь неблагоприятный исход беременности, для исследования с достаточной мощностью потребуется 24–36 пациенток с RFM.
Статистический анализ выполнялся с помощью GraphPad Prism 4.0 (GraphPad Software, Ла-Хойя, Калифорния, США) и Joosse Online Statistics http://in-silico.net/statistics/fisher_exact_test. Нормальность данных сначала была проверена с помощью теста Колмогорова-Смирнова. Для нормально распределенных непрерывных данных использовался t-критерий Стьюдента, а для непрерывных данных с ненормально распределенными данными использовался U-критерий Манна-Уитни. Для анализа более двух наборов данных использовался апостериорный критерий Крускала-Уоллиса с Данна (непараметрический). Категориальные данные были проверены с использованием точного критерия Фишера.Активность системы А оценивали с помощью двухфакторного дисперсионного анализа.
Результаты
Демографические данные
За исследуемый период 7 651 женщина родила в больнице Святой Марии. Из них 351 человек поступил в родильное отделение с RFM, 305 из которых согласились участвовать в исследовании. 36 участников родили в течение 7 дней после оценки. В таблице 1 представлены демографические данные для женщин с RFM и контрольной беременностью, у которых была взята плацентарная ткань. Не было значительных различий в других демографических характеристиках матери, сроке беременности или индукции родов.Женщины в контрольной группе чаще перенесли плановое кесарево сечение.
Двенадцать женщин (33%) с RFM имели неблагоприятный исход беременности, 8 имели SGA в срок, 3 были недоношенными и одна была недоношенной с нормальным весом при рождении. Центиль массы тела при рождении смещен в сторону более низких значений у женщин с RFM (медиана RFM 15 (диапазон 0–100) по сравнению с контрольной 51 (12–96)), что усиливает связь между RFM и SGA. Шесть из 12 пациентов с неблагоприятным исходом после RFM имели признаки патологии плаценты на момент первоначальной оценки (маловодие, аномальная допплерография пупочной артерии).У всех участников с нормальным исходом после RFM были нормальные оценочные вес плода, объем ликвора и допплерография пупочной артерии при первоначальной оценке.
Структура плаценты
Макроскопические изменения в структуре плаценты были очевидны при RFM по сравнению с контрольной беременностью (Таблица 2). По сравнению с нормальной беременностью, плаценты от RFM легче, имеют меньшую площадь поверхности, более высокое соотношение веса плода и плаценты и большую долю занимают аномально выглядящие белые области (рис.1), которые также были видны на поверхности разреза плаценты. .У них также более вероятно нецентральное введение пуповины. Чтобы оценить, был ли этот эффект в первую очередь следствием беременностей с неблагоприятным исходом беременности, был проведен дополнительный анализ, сравнивающий нормальную беременность с RFM с нормальным исходом и с RFM с плохим исходом. Это продемонстрировало, что только плаценты из RFM с плохим исходом имели меньший вес и размер плаценты, чем нормальный контроль. Однако соотношение веса плода и плаценты, доля плаценты с аномальными белыми областями и количество плаценты с нецентральным прикреплением пуповины различались между нормальным контролем и RFM независимо от исхода беременности.
Рисунок 1. Примеры фотографий плаценты от неосложненных (A – B) и RFM (C – D) беременностей.
A ) Фетальная сторона контрольной плаценты с центральным введением пуповины и нормальным распределением сосудов хориональной пластинки. B ) Показывает материнскую сторону контрольной плаценты. C ) Показывает фетальную сторону плаценты RFM, которая менее круглая, чем в контрольном примере, и пуповина вводится сбоку. D ) Показывает материнскую сторону RFM-плаценты.Область, выделенная желтой линией, показывает аномальную белую область, которая была подтверждена на срезанной поверхности плаценты.
https://doi.org/10.1371/journal.pone.0034851.g001
Качественное гистопатологическое исследование показало, что образцы из RFM чаще имели избыточные синцитиальные узлы (p <0,001) и инфаркт (p <0,01) (Таблица 3). Все образцы из RFM показали избыточный синцитиальный по крайней мере в одной области плаценты. На участках, пораженных инфарктом, наблюдались ранние изменения ишемии.Другие аномалии, выявленные при RFM, включали: хронический виллит (очаговый), пятнистые отечные изменения и хорангиоз.
При количественной оценке изменений микроструктуры было отмечено значительное снижение васкуляризации ворсинок и площади синцитиотрофобластов в RFM, но увеличение плотности синцитиальных узлов (Рисунок 2 A – C) и индекса пролиферации (Рисунок 2E). Не было различий в скорости апоптотической гибели клеток, оцененной с помощью иммуноокрашивания M30 (фигура 2D). Когда группа RFM была разделена в соответствии с исходом беременности, наблюдались значительные различия в микроскопической структуре плаценты между нормальными контрольными беременностями и RFM как с нормальным, так и с неблагоприятным исходом беременности (рис. 3).
Рисунок 2. Микроскопическая структура плаценты RFM по сравнению с контрольной беременностью.
A) Плаценты RFM значительно уменьшили васкуляризацию ворсинок (*** p <0,001, U-критерий Манна-Уитни). Репрезентативные микрофотографии иммуноокрашивания CD31. B) В RFM плацента имеет значительно уменьшенную площадь трофобласта по сравнению с контрольной плацентой (** p <0,01, U-критерий Манна-Уитни). Репрезентативные микрофотографии иммуноокрашивания CK7. C) Плотность синцитиальных узлов увеличивается в RFM (*** p <0.001, U-критерий Манна-Уитни). Репрезентативные изображения при окрашивании гематоксилином и эозином, синцитиальные узлы отмечены стрелками. D) Нет существенной разницы в гибели клеток через апоптоз в RFM по сравнению с контрольной плацентой. Репрезентативные изображения от окрашивания M30; Окрашивание М30 отмечено стрелками. E) Индекс пролиферации увеличивается в RFM (** p <0,01, U-критерий Манна-Уитни). Репрезентативные изображения при иммуноокрашивании Ki67 (антиген Mib1). Положительные ядра отмечены стрелками. На всех микрофотографиях полоса = 50 мкм.
https://doi.org/10.1371/journal.pone.0034851.g002
Рис. 3. Микроскопическая структура плаценты RFM, разделенная на плаценты с нормальным и неблагоприятным исходом беременности (PPO).
демонстрирует, что такая же картина аномальной структуры ворсинок присутствует у всех женщин с RFM в отношении: A) Васкулярности ворсинок B) области трофобласта C) плотности синцитиальных узлов D) апоптоза E) индекса пролиферации. (* p <0,05, ** p <0,01, *** p <0,001, критерий Краскела-Уоллиса).
https://doi.org/10.1371/journal.pone.0034851.g003
Корреляция между случаями аномальной КТГ, маловодием или аномальным допплерометром пупочной артерии и микроскопическими анализами плаценты от беременностей с RFM невозможна из-за небольшого количество этих аномалий. Однако была оценена взаимосвязь между центилем веса при рождении и микроскопическими показателями. Не было значимой корреляции между центилем веса при рождении и плотностью синцитиальных узлов, индексом апоптоза, индексом пролиферации или количеством сосудов на ворсинку.Обнаружена положительная корреляция между площадью трофобласта (r 2 = 0,12, p = 0,04) и массой плаценты (r 2 = 0,32, p = 0,003) с центилем массы тела при рождении.
Активность переносчика аминокислот системы A
Активность системы А переносчик аминокислот анализировали в 12 плацентах от беременностей, связанных с RFM, и 12 плацентах от неосложненных беременностей (рис. 4). В присутствии Na + 14 поглощение CMeAIB увеличивается со временем как в контрольной, так и в RFM плаценте (фиг. 4A), и поглощение выше, чем в отсутствие Na + .Зависимый от Na + компонент захвата CMeAIB 14 (активность системы A) значительно снижен в эксплантатах ворсинок плаценты от беременностей, связанных с RFM, по сравнению с образцами, взятыми от неосложненных беременностей (рис. 4B). Снижение активности системы А было еще более выраженным у женщин с RFM, связанной с неблагоприятным исходом беременности (n = 3) (рис. 4B).
Рисунок 4. Система А активность переносчика аминокислот.
A) Система Активность транспортера зависит от натрия, так как не наблюдается поглощения ни одним из нормальных фрагментов плаценты RFM в отсутствие натрия (закрашенные прямоугольники).Поглощение очевидно во фрагментах, инкубированных в присутствии натрия (полые коробки). Б) RFM плаценты имеют значительно более низкую активность системы А, чем при нормальной беременности. Группа RFM с неблагоприятным исходом беременности (PPO) имеет самую низкую активность системы A. [Среднее ± SEM; ** = P <0,01, двусторонний дисперсионный анализ].
https://doi.org/10.1371/journal.pone.0034851.g004
Обсуждение
Плаценты женщин, сообщивших о RFM в течение недели после родов, имели значительные различия в структуре и функции плаценты по сравнению с плацентой, взятой от неосложненных беременностей с нормальными движениями.Эти изменения в структуре и функции плаценты аналогичны признакам плацентарной недостаточности при SGA [19], [30], [31]. Например, увеличение ранних изменений плаценты при инфаркте напоминало изменения, присутствующие у мертворожденных с SGA [32]. Аномалии прикрепления пуповины также были очевидны при RFM и аналогичны наблюдениям, сделанным Biswas и Ghosh при беременностях с SGA [26]. Эта комбинация бокового прикрепления пуповины и аномальной формы плаценты была предложена Salafia et al.приводить к снижению эффективности плаценты, возможно, из-за изменений васкуляризации и ветвления плаценты [33], [34], обеспечивая механизм, связывающий аномальную форму плаценты с RFM, SGA и мертворождением.
Не было исследований апоптоза, пролиферации и площади трофобластов у мертворожденных, чтобы можно было сравнить их с данными RFM. Однако RFM был связан с несколькими аномалиями архитектуры ворсинок плаценты, включая снижение васкуляризации ворсинок и уменьшение площади трофобласта в терминальных ворсинах.Уменьшение васкуляризации ворсинок ранее было обнаружено при SGA и мертворождении [14], [32]. Точно так же площадь синцитиотрофобласта коррелирует с массой тела при рождении и уменьшается при SGA [30]. Комбинация этих аномалий снижает функциональную способность плаценты, тем самым уменьшая снабжение плода кислородом и питательными веществами, что приводит к SGA. Плотность синцитиальных узлов была значительно увеличена в RFM по сравнению с нормальными образцами плаценты, что согласуется с предыдущей работой, которая показала увеличение синцитиальных узлов при патологиях плаценты, таких как SGA и преэклампсия [35], [36].Эти количественные изменения синцитиальных узлов присутствовали в плаценте от RFM независимо от исхода беременности и были подтверждены гистопатологической оценкой плаценты. Взятые вместе макроскопические и микроскопические изменения предполагают, что существует определенная степень аномальной структуры плаценты, связанной с RFM как таковой.
Нарушения в структуре ворсинок сочетаются с изменением функции плаценты в RFM. Активность переносчика аминокислот системы А последовательно снижалась в плаценте женщин, страдающих SGA или FGR [21], [31], и использовалась здесь в качестве маркера функции транспорта питательных веществ через плаценту.Снижение активности системы А в плаценте у женщин, сообщающих о RFM, предполагает, что наряду со структурными аномалиями существует определенная степень функционального нарушения в этих плацентах. В будущих исследованиях необходимо будет изучить другие аспекты функции плаценты, которые могут измениться у женщин, сообщающих о RFM.
Как и все исследования, это исследование имеет некоторые ограничения. Во-первых, существует вероятность систематической ошибки отбора, если женщины с RFM были только из беременных с высоким риском, которым было рекомендовано внимательно следить за движениями плода, тогда это могло бы смещать выборку в сторону женщин с патологией плаценты.Фактически, только 4 случая (11%) RFM имели ранее существовавшие осложнения со стороны матери или плода, что делает такую возможность маловероятной. Во-вторых, ткань плаценты собирали только у женщин, родивших в течение одной недели после обращения с RFM. Это могло способствовать сбору тканей от беременностей, которые были вызваны или доставлены из-за осложнений. Однако получение всей плацентарной ткани затруднило бы связь RFM в начале третьего триместра с патологией плаценты, очевидной при родах.В-третьих, включение преждевременных родов преждевременных родов могло изменить результаты, поскольку патология плаценты может отличаться при недоношенных и доношенных SGA. Всего 4 (11%) случая RFM были преждевременными, и даже если эти случаи исключены, различия в микроструктуре плаценты все еще очевидны. Способ доставки мог повлиять на аспекты обновления плацентарных клеток и транспорта системы А. Однако в этих экспериментах анализ образцов от женщин, перенесших кесарево сечение и вагинальные роды, не показал различий в микроскопической структуре плаценты или активности системы А.
Ни у одной из женщин, включенных в исследование, или у этой плацентарной когорты беременность не закончилась мертворождением. Частично это может быть связано с участием в клиническом исследовании (эффект Хоторна) или улучшенным стандартизированным уходом, который получали все женщины, включенные в исследование, чтобы надлежащим образом управлять признаками компромисса у плода. Таким образом, структурные изменения плаценты при мертворождении после РЧМ не исследованы. Разделив группу RFM на людей с нормальным исходом и пациентов с неблагоприятным исходом беременности, стало возможным показать, что наблюдаемые аномалии не могут быть отнесены исключительно на те плаценты, которые связаны с явной патологией, где структурные аномалии хорошо задокументированы.Это дает доказательства, подтверждающие гипотезу исследования, и позволяет предположить, что у некоторых женщин RFM ассоциируется со степенью плацентарной недостаточности.
Эти данные, связывающие RFM с изменениями в структуре плаценты и нарушением транспорта аминокислот, предполагают, что к женщинам, обращающимся с RFM, следует относиться серьезно и тщательно оценивать для выявления признаков плацентарной недостаточности; особенно острый компромисс плода или FGR / SGA. Текущие тесты для выявления плацентарной недостаточности включают клиническую оценку размера плода путем измерения высоты симфизиофундации и ультразвуковые биофизические профили, но стратегии используются непоследовательно [25], [37], [38].В настоящее время мало доказательств, демонстрирующих, какой тест (если таковой имеется) имеет достаточную чувствительность или специфичность для выявления младенцев с самым высоким риском мертворождения для прямого вмешательства [25]. Учитывая доказательства плацентарной недостаточности у некоторых женщин с RFM, плацентарный биомаркер может быть полезным предиктором неблагоприятного исхода беременности в этой группе. В настоящее время проводится исследование для измерения таких плацентарных биомаркеров и определения их эффективности в прогнозировании неблагоприятного исхода беременности в когорте женщин с RFM.
Благодарности
Авторы хотели бы поблагодарить женщин, принявших участие в этом исследовании, а также акушерок из Центрального родильного отделения и акушерского отделения больницы Святой Марии за их помощь в сборе плацентарной ткани. Этот проект был поддержан Манчестерским центром биомедицинских исследований NIHR.
Вклад авторов
Задумал и спроектировал эксперименты: AH RJ SG CS. Выполнял эксперименты: AH RJ SG LW PD G. Bernatavicius G.Батра. Проанализированы данные: LW PD AH RJ G. Batra. Предоставленные реагенты / материалы / инструменты анализа: CS. Написал статью: LW G. Batra G. Bernatavicius SG PD RJ CS AH. Получено финансирование: AH CS. Набор пациентов: Г. Бернатавичюс AH. Сбор плацентарной ткани: LW G. Bernatavicius RJ AH. Выполненные экспериментальные анализы: LW RJ SG AH. Собранные данные из записей пациентов: G. Bernatavicius AH.
Ссылки
- 1. Конфиденциальное расследование мертворождений и смертей в младенчестве (1995), 3-й годовой отчет.Лондон: Консорциум исследований здоровья матери и ребенка.
- 2. CEMACE (2010) Perinatal Mortality 2008. Лондон, Великобритания: Исследовательский центр по вопросам здоровья матери и ребенка.
- 3. Haws RA, Yakoob MY, Soomro T, Menezes EV, Darmstadt GL, et al. (2009) Снижение количества мертворожденных: скрининг и мониторинг во время беременности и родов. BMC Беременность и роды 9: Дополнение 1S5.
- 4. Пирсон Дж. Ф., Уивер Дж. Б. (1976) Активность плода и благополучие плода: оценка.Br Med J 1: 1305–1307.
- 5. Efkarpidis S, Alexopoulos E, Kean L, Liu D, Fay T (2004) Исследование факторов, связанных с внутриутробной смертностью, методом случай-контроль. Мед Гед Мед 6: 53–58.
- 6. Froen JF, Arnestad M, Frey K, Vege A, Saugstad OD, et al. (2001) Факторы риска внезапной внутриутробной необъяснимой смерти: эпидемиологические характеристики одиночных случаев в Осло, Норвегия, 1986–1995. Am J Obstet Gynecol 184: 694–702.
- 7. Heazell AE, Froen JF (2008) Методы подсчета движений плода и обнаружения компромисса плода.J Obstet Gynaecol 28: 147–154.
- 8. Unterscheider J, Horgan R, O’Donoghue K, Greene R (2009) Уменьшение движений плода. Акушер и гинеколог 11: 245–251.
- 9. O’Sullivan O, Stephen G, Martindale E, Heazell AE (2009) Предсказание плохого перинатального исхода у женщин, которые обращаются со сниженными движениями плода. J Obstet Gynaecol 29: 705–710.
- 10. Rayburn WF (1982) Клинические последствия мониторинга активности плода.Am J Obstet Gynecol 144: 967–980.
- 11. Sinha D, Sharma A, Nallaswamy V, Jayagopal N, Bhatti N (2007) Акушерский исход у женщин, жалующихся на уменьшение движений плода. J Obstet Gynaecol 27: 41–43.
- 12. Warrander LK, Heazell AE (2010) Выявление плацентарной дисфункции у женщин с ограниченными движениями плода может использоваться для прогнозирования пациентов с повышенным риском осложнений беременности. Мед-гипотезы.
- 13. Винцилеос А.М., Флеминг А.Д., Скорца В.Е., Вольф Э.Дж., Балдуччи Дж. И др.(1991) Связь между биофизической активностью плода и значениями газов в пуповинной крови. Am J Obstet Gynecol 165: 707–713.
- 14. Macara L, Kingdom JC, Kaufmann P, Kohnen G, Hair J и др. (1996) Структурный анализ терминальных ворсин плаценты от беременностей с задержкой роста с аномальными формами допплеровских волн пупочной артерии. Плацента 17: 37–48.
- 15. Chen CP, Bajoria R, Aplin JD (2002) Снижение васкуляризации и пролиферации клеток в плаценте плодов с ограниченным внутриутробным ростом с аномальными формами волны скорости кровотока в пупочной артерии.Am J Obstet Gynecol 187: 764–769.
- 16. Smith SC, Baker PN, Symonds EM (1997) Повышенный апоптоз плаценты при ограничении внутриутробного роста. Am J Obstet Gynecol 177: 1395–1401.
- 17. Леви Р., Смит С.Д., Юсуф К., Huettner PC, Kraus FT и др. (2002) Апоптоз трофобластов при беременности, осложненной задержкой роста плода, связан с повышенной экспрессией p53. Am J Obstet Gynecol 186: 1056–1061.
- 18. Crocker IP, Cooper S, Ong SC, Baker PN (2003) Различия в апоптотической восприимчивости цитотрофобластов и синцитиотрофобластов при нормальной беременности от тех, которые осложнились преэклампсией и задержкой внутриутробного развития.Am J Pathol 162: 637–643.
- 19. Heazell AE, Moll SJ, Jones CJ, Baker PN, Crocker IP (2007) Формирование синцитиальных узлов усиливается гипероксией, гипоксией и активными формами кислорода. Плацента 28: S33 – S40.
- 20. Дике Дж. М., Хендерсон Г. И. (1988) Поглощение аминокислот плацентой при нормальной и осложненной беременности. Am J Med Sci 295: 223–227.
- 21. Glazier JD, Cetin I, Perugino G, Ronzoni S, Gray AM и др. (1997) Связь между активностью системы переносчика аминокислот в микроворсинчатой плазматической мембране плаценты человека и тяжестью нарушения внутриутробного развития плода.Pediatr Res 42: 514–519.
- 22. Parast MM, Crum CP, Boyd TK (2008) Гистологические критерии плаценты для ограничения пуповинного кровотока при необъяснимых мертворождениях. Хум Патол 39: 948–953.
- 23. Froen JF, Heazell AE, Tveit JV, Saastad E, Fretts RC и др. (2008) Оценка движения плода. Семин Перинатол 32: 243–246.
- 24. О’Салливан О., Стивен Дж., Мартиндейл Е.А., Хизелл А.Е. (2009) Прогнозирование неблагоприятного перинатального исхода у женщин, у которых наблюдается снижение шевеления плода – предварительное исследование.Журнал акушерства и гинекологии 29: 705–710.
- 25. Froen JF, Tveit JV, Saastad E, Bordahl PE, Stray-Pedersen B и др. (2008) Управление снижением шевеления плода. Семин Перинатол 32: 307–311.
- 26. Biswas S, Ghosh SK (2008) Грубые морфологические изменения плаценты, связанные с задержкой внутриутробного развития плода: исследование случай-контроль. Early Hum Dev 84: 357–362.
- 27. Хизелл А.Е., Лейси Х.А., Джонс С.Дж., Хуппертц Б., Бейкер П.Н. и др.(2008) Влияние кислорода на клеточный оборот и экспрессию регуляторов апоптоза в трофобласте плаценты человека. Плацента 29: 175–186.
- 28. Greenwood SL, Sibley CP (2006) Методы in vitro для изучения плацентарных ворсинок плацентарных ворсинок с переносом аминокислот через плаценту человека. Методы Mol Med 122: 253–264.
- 29. Heazell AE, Sharp AN, Baker PN, Crocker IP (2011) Ограничение внутриутробного роста связано с повышенным апоптозом и измененной экспрессией белков в пути p53 в ворсинчатом трофобласте.Апоптоз 16: 135–144.
- 30. Daayana S, Baker P, Crocker I (2004) Метод анализа изображений для исследования изменений морфологии плаценты при беременности, осложненной преэклампсией, с ограничением внутриутробного развития и без него. Исследование J Soc Gynecol 11: 545–552.
- 31. Янссон Т., Илвен К., Веннергрен М., Пауэлл Т.Л. (2002) Транспорт глюкозы и активность системы А в микроворсинчатых и базальных плазматических мембранах синцитиотрофобластов при ограничении внутриутробного роста.Плацента 23: 392–399.
- 32. Heazell AE, Martindale EA (2009) Может ли патологоанатомическое исследование плаценты помочь определить причину мертворождения? J Obstet Gynaecol 29: 225–228.
- 33. Ямпольский М., Салафия С.М., Шлахтер О., Хаас Д., Ойкер Б. и др. (2009) Центральное расположение пуповины в плаценте человека влияет на эффективность плаценты. Плацента 30: 1058–1064.
- 34. Салафия С.М., Ямпольский М. (2009) Закон метаболического масштабирования плода и плаценты.Плацента 30: 468–471.
- 35. Heazell AE, Moll SJ, Jones CJ, Baker PN, Crocker IP (2007) Формирование синцитиальных узлов усиливается гипероксией, гипоксией и активными формами кислорода. Плацента 28: Suppl AS33–40.
- 36. Apel-Sarid L, Levy A, Holcberg G, Sheiner E (2009) Доношенные и преждевременные (<34 и <37 недель беременности) патологии плаценты, связанные с задержкой роста плода. Arch Gynecol Obstet.
- 37. Heazell AE, Green M, Wright C, Flenady V, Froen JF (2008) Знания акушерок и акушерок и ведение женщин с уменьшенными шевелениями плода.Acta Obstet Gynecol Scand 87: 331–339.
- 38. Фленади В., Макфейл Дж., Гарденер Дж., Чадха И., Магомед К. и др. (2009) Выявление и лечение снижения шевеления плода в Австралии и Новой Зеландии: обзор акушерской практики. Aust N Z J Obstet Gynaecol 49: 358–363.
Нарушение кровотока 1 А степени при беременности: возможные причины, симптомы, методы диагностики и лечение | общество
Во время беременности женский организм начинает восстанавливаться.Поэтому в этот период важно держать под контролем состояние как женщины, так и плода. Согласно медицинской татике,
Содержание:
Во время беременности женский организм начинает восстанавливаться. Поэтому в этот период так важно держать под контролем состояние как женщины, так и плода. Согласно медицинской статистике, у довольно большого количества беременных наблюдается нарушение кровотока. Возникший в организме дополнительный круг кровообращения требует постоянного наблюдения специалистов.Его нарушение может привести к гибели плода, причем произойти это может на любом сроке беременности. Попробуем разобраться, почему нарушается кровоток при беременности.
Немного теории
Всем известно, что плацента действует как связующее звено между телом женщины и плодом. В этой сложной системе различают два типа кровообращения – плацентарный и фетальный. Любое нарушение одного из них может привести к довольно печальным последствиям, вплоть до развития различных заболеваний.Степень серьезности проблемы оценивает только врач.
В этом случае женщине, находящейся на 30 неделе беременности, необходимо обязательно пройти специальную ультразвуковую диагностику, при которой на трехмерном изображении хорошо видны плацентарные сосуды. Если есть какое-либо нарушение, врач обязательно его увидит, так как происходит изменение пространственного соотношения маточного и плодно-плацентарного кровообращения. Это очень опасное состояние организма, так как дыхательная функция подавлена, а развитие плода приостановлено.
Степени нарушения
В медицине выделяют три степени тяжести данной патологии. Первая степень считается самой легкой, когда недостаточное кровообращение еще не достигло критических значений. В этом случае гемодинамика плода находится в удовлетворительном состоянии. Выделяют нарушение маточно-плацентарного кровотока 1 А степени и недостаточное плодно-плацентарное кровообращение 1 Б степени.
Вторая степень характеризуется ухудшением кровоснабжения плода.В 50% случаев происходит снижение максимальной скорости кровотока по всем сердечным клапанам, причем такое нарушение наблюдается как у плода, так и в маточных артериях.
Нередко за короткий промежуток времени вторая степень переходит в третью. В этом случае кровоток к плоду практически перестает поступать, что может вызвать гипоксию. Высока вероятность снижения диастолического кровотока в аорте, а в некоторых случаях он может полностью исчезнуть.
Причины
Если при беременности наблюдается нарушение кровотока 1 степени, причины, приводящие к этому, могут быть разными.Многочисленные неблагоприятные факторы могут повлиять на плаценту не только во время ее формирования, но и в более поздний срок. В медицинской практике различают первичную и вторичную недостаточность кровообращения, при которой нарушается функционирование плаценты, выступающей в качестве транспортного, защитного, иммунного, метаболического и эндокринного органа.
Таким образом, нарушение кровотока 1 А степени при беременности может возникать по следующим причинам:
- отек матки;
- генетические дефекты;
- последствия аборта;
- инфекционные болезни;
- гипертоническая болезнь;
- болезни надпочечников и щитовидной железы;
- структурные аномалии;
- гормональные нарушения;
- поздний токсикоз;
- тромбоз, атеросклероз;
- сахарный диабет.
Если своевременно не устранить данную патологию, то через 6 недель небольшое нарушение кровотока может перейти в третью стадию. Если проблема обнаружена на 30-й неделе, у врача еще есть время принять соответствующие меры для восстановления нормального кровообращения.
Симптомы
Любая патология характеризуется своей клинической картиной, благодаря которой врач может сделать соответствующее заключение. Отсутствие гемодинамики приводит к изменению функционирования плаценты, из-за чего начинает страдать плод.К нему начинают поступать необходимые питательные вещества и кислород в ограниченном количестве, а выведение продуктов обмена замедляется. Начали появляться признаки гипоксии плода, в результате чего его внутриутробное развитие приостанавливается.
Таким образом, при нарушении кровотока при беременности симптомы этого состояния выглядят следующим образом:
- учащенное сердцебиение;
- снижение или повышение двигательной активности плода;
- Несоответствие объема живота конкретному сроку беременности.
Такие признаки обычно возникают при декомпенсированной форме плацентарной недостаточности. Если нарушение маточного кровотока при беременности составляет 1 А или 1 Б степени, то эти симптомы еще не проявляются, так как гемодинамика компенсируется. Обычно выявляется при диагностических исследованиях.
Диагностика
Для выявления нарушения кровотока 1 А при беременности необходимо пройти ряд обследований, с помощью которых вид и степень произошедших изменений, а также определить состояние плод, определяются.В этом случае врач назначает следующие процедуры:
- анализ крови на такие гормоны, как эстрогены, хорионический гонадотропин, прогестерон;
- кардиотокография;
- ультразвуковая процедура;
- допплерометрия.
В некоторых случаях врач уже во время обследования может определить возникшее нарушение, ориентируясь на частоту сердечных сокращений ребенка, которые рассчитываются при аускультации. Но наиболее достоверные результаты обычно получаются после лабораторных и инструментальных исследований.
Лечение
Нарушение маточно-плацентарного кровотока любой степени требует лечения. В основном лечебные мероприятия направлены на предотвращение прогрессирования патологии в будущем. Гемодинамика нормализуется только при выявлении нарушения кровотока 1B степени.
При патологической беременности используются различные средства для улучшения состояния плода. В основном используются консервативные методы лечения. Хирургическое вмешательство возможно только при осложнениях и по жизненным показаниям.При нормализации нарушений кровотока применяется комплекс мероприятий – патогенетическое, этиотропное и симптоматическое лечение.
Медикаментозное лечение
Чаще всего 1 степень Нарушение кровотока во время беременности корректируется медикаментами. При обнаружении начальных признаков нарушения лечение проводится в амбулаторных условиях. Более тяжелая недостаточность кровообращения требует госпитализации.
Для лечения используются следующие препараты:
- спазмолитики – «Эуфиллин», «Но-шпа»;
- сосудистый – «Актовегин»;
- антиагреганты – «Курантил»;
- витаминов и микроэлементов – «Аскорбиновая кислота», «Магне В6»;
- гепатопротекторы – «Хофитол», «Эссенциале»;
- токолитики – «Партусистен», «Гинипрал»;
- улучшение микроциркуляции крови – «Трентал»;
- антигипоксанты – «Инстенон»;
- метаболический – «АТФ».
Обычно для улучшения состояния проводят два курса терапии – сразу после постановки диагноза и сроком 32-34 недели. После этого врач принимает решение о способе родоразрешения. Это особенно важно, если нарушение кровообращения тяжелое. При нарушении кровотока 1 степени роды проходят естественным путем.
Хирургия
При выраженном нарушении кровотока проводится экстренное родоразрешение.В случае неэффективности консервативного лечения даже при легком нарушении решение принимается в течение двух дней. Обычно делается кесарево сечение. Если он запланирован на срок беременности менее 32 недель, то оценивается состояние плода и его жизнеспособность.
Профилактические мероприятия
Во избежание такого патологического состояния, как нарушение кровотока 1 степени при беременности, следует принимать профилактические меры. Женщина, ожидающая ребенка, должна употреблять продукты, содержащие необходимые витамины, микро- и макроэлементы, жиры, углеводы. и белки.Ежедневно следует употреблять не менее 1,5 л жидкости, но только в том случае, если вы не страдаете отеками.
Также важно контролировать свой вес. Во время беременности рекомендуемая прибавка в весе не должна превышать 10 кг. Женщины из группы риска получают профилактику препаратами для взаимодействия систем организма матери с плодом и для предотвращения крайне опасной дисфункции маточно-плацентарного кровообращения. Немаловажную роль играет своевременно выверенная методика ведения родов.Но следует помнить, что даже соблюдение этих мер не исключает возникновения тяжелых неврологических осложнений.
Заключение
Таким образом, очень важно контролировать кровоток во время беременности. Причины нарушения кровообращения могут быть разными. Главное – следить за своим здоровьем, а своевременное обнаружение патологии поможет предотвратить серьезные последствия для будущего ребенка.
Изменения биометрии и цереброплацентарной гемодинамики у плодов с врожденными пороками сердца – Peixoto
Множественные факторы могут влиять на кровоток плода, включая функцию плаценты, анатомию сердца и импеданс дистального сосудистого русла (1).Питательные вещества и кислород подвергаются обмену между кровообращением плода и матери на уровне ворсинок плаценты. Плацента извлекает фиксированную часть потока питательных веществ (70% глюкозы и 40% кислорода, поступающего в матку), тогда как питание плода ограничивается избытком, который остается после потребности плаценты (2).
В кровообращении плода существует три шунтирующих пути: венозный проток (DV), овальное отверстие (FO) и артериальный проток (DA). Они несут ответственность за распределение оксигенированной и деоксигенированной крови к плаценте и органам плода (3).Кислородная кровь из плаценты направляется к плоду в пупочную вену (УФ). Перегородка предсердий и евстахиева клапан работают вместе, направляя насыщенную кислородом кровь из DV через FO в левое предсердие (3). Деоксигенированная кровь из верхней полой вены (SVC) и нижней полой вены (IVC) направляется в правое предсердие. Во время диастолы оксигенированная и деоксигенированная кровь направляется в левый и правый желудочки соответственно. Во время систолы насыщенная кислородом кровь из левого желудочка направляется в миокард, головку, верхнюю и нижнюю части тела.Напротив, дезоксигенированная кровь из правого желудочка направляется к плаценте через главную легочную артерию и DA (3). Выход правого желудочка больше, чем выход левого желудочка, хотя разница не существенна (3).
При пониженном содержании кислорода существует защитный механизм плода, называемый щадящим мозгом, который снижает сопротивление сосудов головного мозга и приводит к увеличению мозгового кровотока (4,5). Во время этого адаптивного ответа ультразвуковая допплерография может выявить снижение индекса пульсации (PI) в средней мозговой артерии (MCA), снижение церебрального / плацентарного отношения (CPR) и повышение PI UA.PI MCA ниже 5-го центиля для гестационного возраста, может быть обнаружен у плодов с задержкой роста, может предсказывать плохой неврологический исход, помимо того, что связан с более высоким уровнем смертности (4,5).
Хорошо известно, что сердечно-сосудистые проявления плацентарной дисфункции у плода различаются для тех плодов, у которых развилось ограничение роста плода с ранним началом (FGR) (до 32 недель) и с поздним началом FGR (после 32 недель) (6). При раннем начале FGR поздние сердечно-сосудистые проявления плацентарной дисфункции становятся более вероятными, когда конечная диастолическая скорость UA меняется на противоположную (REDV-UA) (7).Типичная картина ухудшения прогрессирует от нарастающих аномалий в параметрах UA и венозного допплера до аномальных биофизических параметров (7-10).
При увеличении плацентарной дисфункции происходит уменьшение передачи глюкозы в сердце и мозг; лактат и кетоны метаболизируются как первичные источники энергии (11). Нарушение и дефицит поступления питательных веществ были независимо связаны с широким спектром нарушений нервного развития (2).
Напротив, при позднем начале FGR наблюдается менее тяжелая плацентарная дисфункция с сердечно-сосудистыми изменениями, не выходящими за пределы мозгового кровообращения.У этих плодов ультразвуковая допплерография показала снижение СЛР с нормальным или слегка повышенным ИП МА (12). Несмотря на то, что FGR в срок не имеет такой степени клинического ухудшения, как FGR с ранним началом, аномальная микроструктура мозга и метаболизм были задокументированы независимо от степени аномалий доплеровских волн (13).
У плодов с ранним началом FGR риск неврологических осложнений, двигательной и когнитивной задержки увеличивается по мере уменьшения REDV-UA.Кривые UA отражают тяжесть плацентарной дисфункции и независимо влияют на развитие нервной системы ребенка в случае раннего начала FGR. При позднем начале FGR аномальные формы волны Доплера UA являются менее заметной особенностью, и аномалии развития возникают в других областях, которые, по-видимому, связаны с конкретными областями мозга и более высокими функциями мозга (6).
Напротив, доплеровские формы волн MCA в FGR с ранним началом предоставляют мало дополнительной информации по сравнению с одним только доплеровским режимом UA. При позднем начале FGR допплерография MCA предоставляет важную информацию о сопротивлении кровотоку и структуре развития различных областей мозга плода.У новорожденных это приводит к снижению двигательной активности, социальному взаимодействию и дефициту внимания, в то время как в младенчестве и раннем детстве это может повлиять на производительное внимание, общение, решение проблем, эмоции и социальную функцию (6,14).
Врожденные пороки сердца (ВПС) поражают до 1% всех живорождений и являются основной причиной неонатальной смертности и заболеваемости (13). ИБС считается фактором риска FGR даже при отсутствии связанных хромосомных аномалий (15,16).Однако лежащий в основе механизм еще четко не выяснен. Были предложены объяснения, объясняющие связь между ИБС и ЛГР. Эмбрионы с внутренними нарушениями роста подвержены повышенному риску аномалий развития во время кардиогенеза. Другое объяснение может заключаться в том, что особенности кровообращения плода при наличии определенных сердечно-сосудистых пороков несовместимы с оптимальным ростом плода [16]. Недавно сообщалось, что у плодов с ИБС снижен фактор роста плаценты (PlGF) на сроке беременности 11–13 недель (17).Кроме того, эти плоды обладают более высокой антиангиогенной экспрессией, характеризующейся растворимой fms-подобной тирозинкиназой-1 (sFlt-1), фактором роста эндотелия сосудов A (VEGF-A) и растворимым эндоглином (sEng), чем контроли (18). Эти результаты могут свидетельствовать о том, что нарушение плаценты способствует нарушению потенциального роста плодов с ИБС.
Ballweg и др. . (19) показали, что у плода с ИБС наблюдается плохое неврологическое развитие, вызванное прежде всего кардиохирургическими вмешательствами.Однако есть доказательства того, что травмы головного мозга у пациентов с ИБС могут быть обнаружены при рождении и могут быть вызваны хронической церебральной гипоксией из-за прямой доставки дезоксигенированной крови или внутрисердечного смешивания оксигенированной и деоксигенированной крови во время плода (20).
Донофрио и др. . (20) были первыми, кто сообщил об измерениях уменьшения окружности головы (ОГ) у плодов с ВПС в третьем триместре. Точно так же Arduini и др. . (21) обнаружили снижение ГК на 34 неделе беременности.Масоллер и др. . (22) впервые задокументировали, что значительная часть плодов с ИБС уже имеет бипариетальный диаметр (БПД) и значения ГК ниже 5-го перцентиля (50% и 25% соответственно) для ожидаемого гестационного возраста во втором триместре беременности. беременность. Напротив, у плодов с FGR из-за плацентарной недостаточности, возникающей в середине беременности, окружность живота (AC) и длина бедра (FL) более ограничены в росте, чем значения HC (6).
В последние годы диагноз ИБС был диагностирован раньше благодаря техническому прогрессу в ультразвуковом оборудовании, особенно благодаря широкому использованию аппаратов высокого разрешения в реальном времени.Пренатальное консультирование по поводу ИБС является сложной задачей для специалистов по фетальной медицине, хотя расширенные знания об этих заболеваниях вместе с достижениями кардиохирургии все еще связаны с критическими показателями выживаемости и плохим развитием нервной системы в более позднем возрасте (23,24).
Масоллер и др. . (25) провели исследование с 58 плодами с ИБС против . 58 контролей с использованием ультразвуковой допплерографии, биометрии головы и магнитно-резонансной томографии (МРТ), соответственно, между 20–24 неделями и 36–38 неделями беременности.В этом исследовании плоды с ИБС имели значительно меньшие средние Z-баллы БЛД и НС и более высокую долю плодов с БЛД и НС <5-го центиля. Никаких различий в AC и FL не наблюдалось. Плоды с ВПС показали значительно более низкие средние Z-баллы для MCA-PI и CPR, чем в контроле. Что касается результатов МРТ, плоды с ИБС показали значительно меньшие мозговые, внутричерепные и глазные объемы, чем в контрольной группе. Кроме того, у плодов с CDH значительно уменьшилась глубина левой и правой теменно-затылочных, поясных и калькариновых трещин и значительно увеличилась глубина левой островковой доли по сравнению с контрольной группой.Что касается спектроскопического анализа, у плодов с ИБС было показано повышенное соотношение Ino (мио-инозит) / (холин) Cho в лобной доле и базальных ганглиях и пониженное соотношение NAA (N-ацетиласпартат) / Cho и Cho / (креатин) Cr в обоих случаях. области по сравнению с элементами управления. Новорожденным, не нуждающимся в операции на открытом сердце в течение первых 6 месяцев жизни, была проведена третья редакция «Шкалы развития младенцев и малышей» Бейли (BSID-III) (26) для оценки результатов развития нервной системы. Результаты развития нервной системы, представленные в результатах по месяцам / годам, выявили линейные корреляции между средними баллами по шкале BSID-III и общим объемом мозга (r = 0.410; P = 0,02), глубина левой и правой поясной щели (r = 0,359; P = 0,04 и r = 0,337; P = 0,04 соответственно), лобное отношение Ino / Cho (r = –0,531; P <0,01) и NAA / Cho соотношение (r = 0,452; P <0,01).
Руис и др. . (27) провели интересное ретроспективное исследование в двух центрах третичной медицинской помощи в Испании, где было проведено 444 ультразвуковых исследования между 20–24 неделями беременности и у 119 плодов была выявлена ИБС. Основная цель этого исследования состояла в том, чтобы установить, развивается ли нарушение роста головы и тела плода на протяжении всей беременности, в то время как вторичные цели заключались в том, чтобы установить, могут ли происходящие изменения быть связаны с конкретным типом доставки кислорода в мозг плода и может ли быть связана плацентарная перфузия. изменениям размеров головы и тела у плодов с ИБС.
Чтобы проанализировать влияние церебральной гемодинамики, в соответствии с ожидаемым основным паттерном плацентарного (насыщенный кислородом, богатый питательными веществами) против . системная (дезоксигенированная, бедная питательными веществами) смесь кровоснабжения мозга плода при различных типах ИБС, исследуемая популяция была стратифицирована следующим образом с использованием ранее опубликованной классификации (22):
- Группа 1: ожидаемое низкое содержание крови в плаценте, включая тяжелую обструкцию левого оттока с обратным током в перешейке аорты (и, следовательно, ретроградную перфузию церебральной крови из DA) и транспозицию магистральных артерий (TGA) с кровотоком аорты происходящие из правого желудочка.
- Группа 2: ожидаемое промежуточное содержание плацентарной и системной крови из-за внутрисердечных шунтов (дефекты перегородки, конотрункальные дефекты, отличные от ТГА, и комплексная ИБС).
- Группа 3: ожидаемое высокое содержание плацентарной крови, при которой перфузия головного мозга происходила из левого желудочка через правильно сформированную аорту (правая ВПС), включая легочный стеноз, атрезию трикуспидального клапана, аномалию Эбштейна и атрезию легочной артерии.
Руис и др. .(27) обнаружили, что у плода с ИБС при ультразвуковой диагностике наблюдалась небольшая голова (БЛД -1,32 ± 0,99 Zs, HC -0,79 ± 1,02 Zs), которая оставалась маленькой на протяжении всей беременности, что было подтверждено при рождении (HC Zs -0,56). ± 1,21, 71 st центиль). Плоды с CDH имели нормальные измерения AC (0,49 ± 0,88 Zs, 69-й центиль) и FL (-0,04 ± 0,49 Zs, 48 th центиль). У плода с ИБС во втором триместре результаты ультразвукового допплеровского анализа были в пределах нормы: UA-PI Zs (-0.45 ± 0,65, 33 rd центиль), MCA-PI Zs (-0,36 ± 1,28, 36 th центиль), Zs CPR (-0,29 ± 1,37, 39 th центиль) и UtA-PI Zs (0,17 ± 2.20, 57 th центиль). Однако у 18% плодов с ВПС во время первого обследования СМА и СЛР были ниже 5-го центиля. Параметры ультразвука UtA и UA Doppler показали значительное увеличение к концу беременности, тогда как никаких значительных изменений для MCA или CPR с увеличением гестационного возраста не наблюдалось. И MCA, и CPR показали значительные различия в продольном поведении между группами CHD.
Основные наблюдения исследования Руиса и др. . (27) утверждали, что биометрические измерения головы оставались меньше нормальных на протяжении всей беременности и что гемодинамика плаценты показывала ухудшение к концу беременности, независимо от типа аномалии ИБС. Эти данные могут свидетельствовать о том, что причина аномального развития мозга могла присутствовать уже с начала беременности.
Идентификация пренатальных маркеров аномального развития нервной системы у плодов с ИБС может быть полезна для лучшего понимания патофизиологических изменений плода и улучшения клинического консультирования.
Исследование Руиса и др. . (27), хотя ретроспективный анализ небольших выборок плодов с различными ИБС, может способствовать увеличению наших знаний о потенциальном росте плодов с CDH. В предыдущем исследовании тех же авторов (23) была продемонстрирована линейная корреляция между задержкой развития нервной системы и клиническими переменными, такими как объем мозга плода, глубина трещин мозга и метаболический рацион при оценке МРТ.
Таким образом, хорошо известно, что дисфункция плаценты связана с задержкой роста плода.Ультразвуковая допплерография – важный инструмент для лучшего понимания процесса гемодинамической адаптации, от которого страдают плоды, и последующего прогнозирования исходов развития нервной системы новорожденных. ИБС является фактором риска ЛГР, однако лежащий в основе механизм еще не выяснен. Похоже, что у плодов с ИБС наблюдается снижение ангиогенных факторов и увеличение антиангиогенных факторов, предрасполагающих к дисфункции плаценты. Плоды с ИБС имеют небольшую головку со второго триместра и далее, которая остается меньше, чем обычно, на протяжении всей беременности, а также значительную тенденцию к повышению резистентности в Допплерографии UtA и UA.Эти данные связаны с задержкой развития нервной системы даже до открытой кардиохирургии. Корреляция между ИБС, дисфункцией плаценты на протяжении всей беременности, меньшей головкой плода, меньшим размером мозга плода и задержкой нервного развития позволяет улучшить консультирование в отношении прогнозирования и предотвращения аномального развития нервной системы в случаях ИБС.
Благодарности
Нет.
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Список литературы
- Heymann MA, Rudolph AM. Влияние врожденного порока сердца на кровообращение плода и новорожденного. Prog Cardiovasc Dis 1972; 15: 115-43. [Crossref] [PubMed]
- Башат А.А. Реакции плода на плацентарную недостаточность: обновленная информация. BJOG 2004; 111: 1031-41. [Crossref] [PubMed]
- Рудольф AM. Кровообращение плода и послеродовая адаптация. В: Рудольф AM (ред.) Врожденные болезни сердца: клинико-физиологические соображения, 2-е изд.Нью-Йорк 2001; 3-43.
- Мари Г, Детер Р.Л. Кривые скорости кровотока в средней мозговой артерии у нормальных и малых для гестационного возраста плодов. Ам Дж. Обстет Гинекол 1992; 166: 1262-70. [Crossref] [PubMed]
- Rizzo G, Arduini D, Luciano R и др. Пренатальная церебральная допплерография и неврологический исход новорожденных. J Ultrasound Med 1989; 8: 237-40. [PubMed]
- Башат А.А. Нейроразвитие после задержки роста плода и его связь с дородовыми параметрами плацентарной дисфункции.Ультразвуковой акушерский гинеколь 2011; 37: 501-14. [Crossref] [PubMed]
- Ferrazzi E, Bozzo M, Rigano S и др. Временная последовательность аномальных допплеровских изменений в периферической и центральной системах кровообращения у плода с серьезной задержкой роста. Ультразвуковой акушерский гинеколь 2002; 19: 140-6. [Crossref] [PubMed]
- Башат А.А., Гембрух У., Харман ЧР. Последовательность изменений допплеровских и биофизических параметров по мере ухудшения серьезной задержки роста плода. Ультразвуковой акушерский гинекол 2001; 18: 571-7.[Crossref] [PubMed]
- Cosmi E, Ambrosini G, D’Antona D и др. Допплерография, кардиотокография и изменения биофизического профиля у плодов с задержкой роста. Obstet Gynecol 2005; 106: 1240-5. [Crossref] [PubMed]
- Vintzileos AM, Fleming AD, Scorza WE, et al. Связь между биофизической активностью плода и значениями газов в пуповинной крови. Am J Obstet Gynecol 1991; 165: 707-13. [Crossref] [PubMed]
- Vannucci RC, Ваннуччи SJ. Метаболизм глюкозы в развивающемся мозге.Семин Перинатол 2000; 24: 107-15. [Crossref] [PubMed]
- Туран ОМ, Туран С., Гунгор С. и др. Прогрессирование допплеровских аномалий при задержке внутриутробного развития. Ультразвуковой акушерский гинеколь 2008; 32: 160-7. [Crossref] [PubMed]
- Хоффман Дж. И., Каплан С. Заболеваемость врожденными пороками сердца. Дж. Ам Колл Кардиол 2002; 39: 1890-900. [Crossref] [PubMed]
- Орос Д., Фигерас Ф., Крус-Мартинес Р. и др. Допплер средней и передней церебральной артерии для прогнозирования перинатального исхода и нейроповедения новорожденных у доношенных плодов с малым для гестационного возраста допплерометром с нормальной пупочной артерией.Ультразвуковой акушерский гинеколь 2010; 35: 456-61. [Crossref] [PubMed]
- Perez-Delboy A, Simpson LL. Пренатальная сонографическая диагностика врожденных пороков сердца и задержки внутриутробного развития: исследование случай-контроль. J Clin Ultrasound 2007; 35: 376-81. [Crossref] [PubMed]
- Rosenthal GL. Закономерности внутриутробного роста новорожденных с сердечно-сосудистыми пороками: возможные гемодинамические эффекты плода. Am J Epidemiol 1996; 143: 505-13. [Crossref] [PubMed]
- Llurba E, Syngelaki A, Sánchez O, et al.Фактор роста плаценты в сыворотке крови матери на сроке беременности 11-13 недель и пороки сердца плода. Ультразвуковой акушерский гинеколь 2013; 42: 169-74. [Crossref] [PubMed]
- Llurba E, Sánchez O, Ferrer Q и др. Ангиогенный дисбаланс матери и плода при врожденных пороках сердца. Eur Heart J 2014; 35: 701-7. [Crossref] [PubMed]
- Ballweg JA, Wernovsky G, Gaynor JW. Исходы нервного развития после врожденных операций на сердце. Педиатр Кардиол 2007; 28: 126-33. [Crossref] [PubMed]
- Донофрио М.Т., Бремер Ю.А., Шикен Р.М. и др.Ауторегуляция церебрального кровотока у плодов с врожденными пороками сердца: эффект сохранения мозга. Педиатр Кардиол 2003; 24: 436-43. [Crossref] [PubMed]
- Arduini M, Rosati P, Caforio L и др. Ауторегуляция церебрального кровотока и врожденные пороки сердца: возможные причины аномального пренатального неврологического развития. J Matern Fetal Neonatal Med 2011; 24: 1208-11. [Crossref] [PubMed]
- Масоллер Н., Мартинес Дж. М., Гомес О. и др. Доказательства изменений биометрии головы и перфузии мозга во втором триместре у плодов с врожденным пороком сердца.Ультразвуковой акушерский гинеколь 2014; 44: 182-7. [Crossref] [PubMed]
- Донофрио МТ, Массаро АН. Влияние врожденного порока сердца на развитие мозга и исходы нервного развития. Int J Pediatr 2010; 2010. pii: 359390.
- Халил А., Суфф Н., Тилаганатан Б. и др. Аномалии мозга и задержка нервного развития при врожденных пороках сердца: систематический обзор и метаанализ. Ультразвуковой акушерский гинеколь 2014; 43: 14-24. [Crossref] [PubMed]
- Masoller N, Sanz-CortéS M, Crispi F и др.Допплерография мозга и биометрия головы в середине беременности у плодов с врожденным пороком сердца позволяют прогнозировать аномальное развитие мозга при рождении.


 д.)
д.)